|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractObjectivesThis study aims to assess the feasibility of simultaneously producing hydrogen and hypochlorous acid using a 2-compartment PEM water electrolysis cell with an installed membrane electrode assembly (MEA).
MethodsExternal power was applied to the PEM water electrolysis device through a potentiostat to induce the electrolysis reaction and to confirm the production of hydrogen and hypochlorite simultaneously. Linear Sweep Voltammetry (LSV) experiments were conducted, thereby determined the minimum voltage required for the electrolysis. Constant current experiments were performed by applying a fixed current of 1 A for 1 hour, measuring voltage changes every second to evaluate the stability and efficiency of hydrogen production. The hydrogen production rate was measured using a mass flow meter, while the hypochlorite production was determined using a portable free chlorine photometer.
Results and DiscussionIn this study, the minimum voltage required for hydrogen generation in a PEM water electrolysis cell was investigated using LSV with Deionized (DI) water. The results showed that the current increased from around 1.4 V, indicating an approximate voltage efficiency of 82%. NaCl was introduced to the anode in the PEM electrolysis cell to induce electrochemical reactions. When the anolyte was NaCl, the voltage was observed to increase by 0.77 V compared to using DI water. Optimization experiments were conducted to investigate the influence of electrolyte concentration and flow rate on hypochlorite and hydrogen production. As the electrolyte concentration increased, the hypochlorite generation also increased, with a maximum of 104±0.50 mg/L observed with NaCl 10 g/L. Additionally, when the flow rate was reduced, the hypochlorite production increased, and at a reduced flow rate of 5 mL/min compared to 20 mL/min, hypochlorite generation increased by 127.3%. However, the hydrogen production showed no significant variation with NaCl concentration or flow rate.
ConclusionThis study explores a novel approach using PEM water electrolysis technology to simultaneously produce hydrogen and chlorinated disinfectants. The research employed a PEM electrolysis cell with the MEA to generate both chlorine-based compounds and hydrogen. By varying the concentration and flow rate of the anolyte, the production efficiencies of hypochlorite were compared. This system showed that PEM electrolysis can be a promising alternative for disinfection and energy production in terms of environmental protection and cost-effectiveness.
요약방법외부 전력을 Potentiostat를 통해 수전해 장치에 인가하고 수전해 반응을 유도하여 수소와 차아염소산염이 생성을 확인하였다. Linear Sweep Voltammetry(LSV) 실험으로, 수전해에 필요한 최소 전압을 확인하기 위해 전압 스캔 범위를 조절하며 전압 변화에 따른 수소 생산량을 관찰하고, 수전해에 필요한 최소 전압과 효율을 계산하였다. 또한 정전류 실험으로 1A의 정전류를 인가하여 수소 생산의 안정성과 효율을 평가하였다. 수소 생산량은 질량유량계를 이용하여 측정하였으며, free chlorine 농도를 측정함으로써 차아염소산염 생성량을 확인하였다.
결과 및 토의PEM 수전해 셀에서 수소를 생성하기 위해 필요한 최소 전압을 확인하기 위해 DI water를 사용하여 LSV실험을 수행하였다. 그 결과 약 1.4 V에서부터 전류가 증가하는 것을 확인할 수 있었고, 이때의 전압 효율은 약 82% 정도 되었다. 차아염소산염 생산을 위해 anode에 NaCl을 주입하여 전기화학 반응 실험을 진행하였다. 전해질에 NaCl 용해되어 있을 때, 동일한 전류에서 전압이 DI water를 사용한 경우보다 0.77 V 증가하였다. 또한 전해질 농도와 유량에 따른 전극 접촉시간이 차아염소산염과 수소 생산에 미치는 영향을 조사하기 위해 최적화 실험을 수행하였다. 전해질 농도가 증가함에 따라 차아염소산염의 생성량이 증가하는 경향을 확인하였으며, NaCl 10 g/L일 때 Free chlorine 104±0.50 mg/L 발생하였다. 유량이 감소하는 경우 차아염소산염의 발생량이 증가하는 경향을 보였으며, 이는 전극 접촉시간이 증가함에 따라 차아염소산염 생산량이 증가하는 것으로 판단되었다. 하지만 수소 발생량은 NaCl농도와 유량에 따른 변화가 없었다.
1. 서 론전기분해기술은 외부전압을 전극을 통해 인가하여 오염물질을 전기화학적으로 분해하여 처리하는 기술이다. 이 기술은 생물학적으로 처리가 어려운 고농도 폐수 및 난분해성 물질을 전기화학적 산화환원 반응을 통해 분해하거나 물을 분해하여 수소를 생산하는 데 사용된다[1]. 수전해를 통해 생산된 수소는 생산 과정에서 온실가스 배출되지 않는 장점이 있지만[2], 부생수소 또는 개질수소와 같은 다른 수소생산 기술에 비교하면 수소생산 단가가 높아 경제성이 낮다[3]. 그러나 최근 탄소중립 실현을 위한 사회적 요구가 증가함에 따라 수전해 기술은 신재생 에너지와 연계 가능성으로 인해 저탄소 에너지 생산기술로 큰 관심을 받고 있다[4,5]. 수전해기술은 전해질의 종류에 따라 크게 알칼라인 수전해(Alkaline water electrolysis, AWE)와 고분자 전해질막 수전해(Polymer electrolyte membrane water electrolysis, PEMWE), 그리고 고체 산화물 수전해(Solid oxide electrolysis cell, SOEC)로 구분할 수 있다. 그 중 PEMWE는 양이온 교환막 수전해(Proton exchange membrane water electrolysis)라고도 불리며, 양이온 교환막을 통해 수소이온을 선택적으로 통과시킴으로써 고순도 수소생산이 가능하고, 높은 전류 밀도를 통해 높은 수소생산 효율을 보인다. 그러나 PEM 수전해는 산성환경에서도 작동할 수 있는 Ir, Ru, Pt 등 고가의 귀금속 촉매를 사용해야 하므로 경제성이 낮은 단점이 있다[6].
앞서 언급한 것과 같이, 전기분해 기술은 수소생산에도 활용 가능하지만, 직접 산화 또는 간접 산화 방식을 통한 전기화학적 수처리 기술은 생물학적으로 처리가 어려운 고농도 폐수와 난분해성 물질을 분해할 수 있으며[4], 기존 처리 기술을 운영할 때 필요한 비용과 약품 투입비를 비교하면 본 기술의 경제성이 높다고 알려져 있다. 이 기술을 활용하여 난분해성 오염물질을 제거할 수 있다[7]. 직접 분해는 전기화학적 산화환원 반응을 통해 오염물질을 직접적으로 분해하는 것이며, 간접 분해는 유입수에 약품을 첨가하여 산화제를 생성하고 이산화제가 오염물질을 분해하는 반응을 일으킨다. 간접 분해 방식 중 NaCl을 첨가하여 차아염소산나트륨(NaOCl)을 생성하여 수처리를 하는 방법이 있다[8].
차아염소산나트륨은 산화제 또는 소독제로 사용할 수 있는 물질이지만, 기존의 소독공정에서는 대부분 염소를 소독제로 사용하고 있다. 염소소독은 저렴한 운영 비용과 잔류염소 농도 관리의 편리함 등의 이점을 가지고 있다. 그러나 액화수소를 사용하는 염소소독은 독성이 강한 고압 가스 형태로 제조, 운반 및 보관과정에서 누설 사고, 화재 발생 등 심각한 위험이 있다. 이러한 단점을 보완하기 위해 높은 소독 효과와 적은 상수도관 부식 등의 이점을 가진 차아염소산나트륨을 소독제로 선택된다[9].
차아염소산염 생산용 전해셀 구조는 크게 무격막식 전해셀과 격막식 전해셀로 구분될 수 있지만, 반응 기작은 동일하다. 무격막 전해셀은 간단한 구성을 가지지만, 낮은 유효염소 농도(0.8% 이내)를 생산하기 때문에 현장 적용을 위해서는 대용량 설비비로 인하여 경제성이 확보되지 않는 것이 단점이다. 반면, 격막식 전해셀은 양이온교환막을 anode와 cathode 사이에 설치함으로써 양극과 음극에서 각각 고순도의 Cl2와 NaOH를 생산할 수 있으며, 고농도 유효 염소(5~13%)를 생산할 수 있다[10]. 그러나 분리막 설치와 전극 사이 간극 등으로 전해셀 내 저항이 증가하게 되므로, 전해를 위해 필요한 전압을 증가시키는 것이 필수적이다.
따라서, 본 연구는 셀 저항을 최소화한 격막식 PEM 수전해 셀에서 수소 및 차아염소산염 동시 생산 가능성을 알아보고, 최적운전조건을 찾는 것을 목표로 한다. 이를 위하여 MEA(Membrane Electrode Assembly)가 장착된 격막식 PEM 수전해셀을 적용하여 전기화학적 특성과 수소생산량, 차아염소산염 생산 특성을 비교해 보았다. 높은 수소생산 효율을 가진 시스템이지만 경제성이 낮은 단점을 가진 PEM 수전해 기술에서 수소 및 차아염소산염을 생성하는 에너지 생산형 수처리 기술로 보완할 수 있는 새로운 방안을 제시하고자 한다.
2. 실험방법2.1. PEM 수전해 장치 구성본 연구의 실험 모식도는 Fig. 1과 같으며, 시료는 peristaltic pump를 통해 PEM stack에 유입되고, Potentiostat(Automatic battery cycler WBS 3000 M1, WonATech, Seoul, South Korea)를 통해 외부전력을 인가하여 수전해 반응을 유도하였다. 수전해를 통해 생산되는 수소는 단위시간 동안 흐르는 유체의 질량을 측정하는 질량유량계(Mass flow meter(MF-200MV)와 controller(RD-2000)을 통해 유량을 측정하였다. 질량유량계의 타겟 유체는 수소 가스이고, 측정 범위는 20SCCM(Standard Cubic Centimeter per Minute)이고, Mass controller 응답속도는 250 ms으로 설정하였고, 10초 간격으로 데이터를 수집하였다. 수전해를 통해 처리된 물은 재순환하지 않고 분석을 위해 샘플링하거나 배수하였다. 실험 조건 중 언급이 없는 경우 전해질 유량은 10 mL/min이었다.
본 연구에 사용된 PEM cell은 WESPE제품(Active Area 25 cm2 stack, WESPE, Seoul, South Korea)을 사용하였고 MEA와 Mesh-Gasket, bipolar plate와 end plate로 구성되어 있다. PEM cell과 MEA의 상세 스펙은 Table 1에 정리하였다.
차아염소산염 생성실험을 위해 Anolyte는 NaCl(99.0%, Sigma Aldrich, Missouri, USA)을 사용하였다. 수전해실험을 통해 발생한 차아염소산염 생성량을 확인하기 위해 Free Chlorine은 잔류염소 측정기(HI97701, HANNA instruments)를 이용하였다. Free Chlorine은 HOCl, OCl- 등 유리염소종으로 측정법은 DPD 비색법(EPA Method 330.5)이며, 측정 범위는 0.00~5.00 mg/L(as Cl2)이다.
2.2. 최적 조건 규명 실험2.2.1. Linear Sweep Voltammetry본 연구에서는 Potentiostat서 LSV 실험을 통해 수전해에 필요한 최소전압을 확인하고자 하였다. 실험을 위하여 2 전극법을 적용하여 anode에는 상대전극과 기준전극을, cathode에는 작업 전극과 작업감지 전극을 연결하였다. 상세한 LSV 실험 조건은 Table 2에 나타내었다.
2.2.2. 정전류 실험외부 전력 공급 장치로 Potentiostat의 cycler mode를 사용하였으며, 2 전극법으로 anode는 상대전극과 기준전극을 cathode는 작업전극과 작업 감지전극을 연결하였다. 실험 조건은 Table 3와 같이 1 A의 정전류 실험을 진행하여 1 시간 동안 매초 전압 변화를 측정하였다.
2.2.3. PEM 셀 효율 계산수전해에서 셀 전압과 전류 또는 전류밀도는 밀접한 관계에 있다. 전류밀도는 패더데이 법칙에 의한 수소 생산 속도와 거의 비례한다. 이상적인 물 전기분해 셀의 페러데이 법칙에 의해 결정되는 전류효율(Ƞc)은 식 (1)과 같이 이론적 수소생산 속도(UtH2)와 실제 수소생산 속도(UaH2)의 비로 정의된다.
이론적인 수소생산 속도는 이상기체 방정식과 페러데이 전기분해 법칙에 따라 계산할 수 있다. 이상기체 방정식은 보일의 법칙, 샤를의 법칙, 아보가드로 법칙을 하나의 식으로 표현한 방정식으로, 기체의 종류와 상관없이 온도, 압력이 일정할 때, 부피가 일정하고 분자의 수도 같다는 것을 의미한다. 따라서 식 (2)와 같이 이상기체 방정식을 통해 이론적인 수소생산 속도를 계산할 수 있다.
3. 결과 및 고찰3.1. PEM 수전해 cell에서의 수소 생성능본 실험에서는 PEM 수전해 셀에서 수전해를 발생시키기 위해 필요한 최소 전압을 확인하기 위해 DI water를 넣어 LSV 실험을 수행하였다. Fig. 2(A)에서 전압을 1.2 V에서 1 mV/s의 속도로 전압을 증가시키며, 약 200초 후에 약 1.4 V에서부터 전류의 증가가 관찰되었다. 수소를 생산하기 위한 최소 이론 전압 1.23 V와 실측 최소 전압이 1.4 V라고 할 경우, 이 결과를 통해 본 실험에서 사용된 PEM 수전해 셀의 전압 효율이 약 88%임을 확인할 수 있었다. 수전해 실험 시 수소 발생은 Mass flow meter을 통해 측정되었으며, 실험 시작 후 약 290초 후인, 전압 1.5 V 부근에서 수소 발생이 감지되었다. 전류 증가 시점보다 수소 발생 시점이 지연된 이유는 실험에 사용된 Mass flow meter의 최소 측정 한계 때문이다. 해당 장치의 최소 측정 한계는 최대측정유량의 2%, 즉 0.4 ml/min까지 측정이 가능하다. 따라서 1.5 V 이전에도 수전해로 인한 수소발생이 시작되었더라도, 측정 가능한 범위보다 낮아 수소 생산 측정 시점 지연된 것으로 보인다.
일반적으로 전류밀도가 증가함에 따라 수소발생률도 비례하기 때문에, 본 연구에서는 동일한 전류밀도 유지를 위하여 정전류 실험으로 진행하였다. Fig. 3은 정전류에 따른 수전해 시스템 전압과 수소 생산량을 나타낸다. 실험 결과, Fig. 3(A)에서 1 A의 정전류를 인가했을 때, 전압은 약 1.56~1.58 V로 확인되었다. 진행 시간에 따라 미세하게 증가하는 전압은 MEA의 열화로 인한 성능 저하의 영향으로 보인다. MEA의 촉매 입자는 소결로 인한 단일 촉매 입자의 크기 증가 또는 시간 경과에 따른 결정 크기 증가로 인해 전기화학적 표면적의 손실이 발생한다. 따라서 수전해 진행 과정에서 지속적으로 촉매층을 손상시키고 촉매의 탈착으로 이어지게 되어 열화가 발생한다. 또한 양이온 오염으로 인해 MEA 열화 현상이 발생할 수 있다. 양이온 불순물은 유입수, 관, Stack, 부식, MEA 제조 과정 등에서 발생할 수 있으며, 양이온 불순물은 촉매층으로 이동하여 전해질 막의 이온 교환 자리를 점유하여 전하 이동 저항을 증가시키는 것으로 알려져 있다[11]. 또한, MEA를 구성하는 고분자 막은 라디칼에 의한 전기화학적 열화와 수축/팽창에 의한 기계적 열화가 내구성 감소의 주요 원인으로 알려져 있다[12,13].
3.2. 차아염소산염 생성능 실험일반적으로 격막식이 아닐 경우 anode 에서 발생된 Cl2와 cathode 에서 발생한 NaOH가 기액접촉반응에 의해서 차아염소산나트륨을 생산할 수 있다[14]. 그러나 PEM 수전해 셀에서는 anode에 물분해에 의해서 수소이온이 생성되고, 주입된 NaCl이 전기화학적인 반응에 의해 Cl2를 발생시킨다. 이 과정에서 물분해에 의해 발생한 O2 발생반응과 경쟁적인 전기화학반응으로 전극의 특성, 전해질의 조건에 따라 반응의 효율은 결정된다. 또한, cathode에서는 membrane을 통해 넘어온 수소이온이 전자를 얻어 H2 가스로 변환된다. Anode에서 발생된 Cl2와 물분자가 결합하여 차아염소산염(HOCl)을 생산할 수 있다.
수전해 셀에서 차아염소산염 생산능을 확인하기 위하여 수전해와 동일한 조건에서 Anolyte를 NaCl 10 g/L로 변경하여 정전류 실험(1 A)을 수행하였다. 1 A의 전류를 유지하기 위하여 전압이 DI를 Anolyte로 사용하였을 때보다 0.77 V 증가한 것을 관찰할 수 있었다(Fig. 4(A)). 이 실험에 사용된 양이온 교환막의 수소이온의 전달은 proton의 이동 통로인 sulfonated ether sulfone 작용기에 의해 결정되는데 Anolyte의 NaCl의 나트륨이온이 작용기에 전기화학적으로 수소이온과 경쟁하기 때문에 proton 이동, 즉 수소이온전도도가 감소하게 되었기 때문으로 판단된다[15]. 또한, 반응시간에 따라 미세하게 증가하는 전압은 Fig. 3과 동일한 요인의 결과이다. Anolyte가 NaCl일 때, 전압 증가율은 3.31×10-5 V/sec로 DI water 수전해 때의 증가율보다 6.7 배 빠른 것으로 나타났다. 실제 수전해에 의한 수소생산은 다양한 요소의 저항때문에 이론적인 과전압(1.2 V)보다 높은 전압에서 이루어지며, 높은 전압일수록 수전해반응에서 전극과 고분자 전해질 막의 열화가 빠르게 진행되는 것으로 알려져 있다[13]. 반응시간동안 수소는 7.51~7.72 mL/min의 범위에서 발생하였으며, 차아염소산염은 1800초에서 약 0.13±0.04 mg/L 생성됨을 확인할 수 있었다.
3.3. 차아염소산염 생성과 수소생산의 최적화 실험수전해 실험에서 전극과 촉매의 종류, 전극의 구조, 전극의 간격, 전류밀도, 전해질의 농도 및 pH, 전극접촉시간, 온도 등의 다양한 요소에 의해 셀효율이 영향을 받는다[2]. 이러한 인자들은 수전해 반응의 효율을 최적화하는데 각각 중요한 역할을 하며, 최적화하는 과정이 필요하다. 본 연구에서 중요한 영향인자인 전해질 농도와 유량에 따른 전극 접촉시간이 차아 염소산염 생산과 수소발생에 미치는 영향을 알아보기 위해 진행되었다. 이를 위해 anolyte에서의 Free chlorine 생성량을 측정하였고, 해당 결과를 Fig. 5에 나타냈다. 실험에서는 최대 반응시간 1800초 동안 다양한 전해질 농도와 유량을 조절하여 각각의 조건에서 차아염소산염 발생량과 수소발생량을 측정하여 비교하였다.
Fig. 5(A)에서 확인할 수 있듯이, 반응시간 1800초에서 전해질 농도가 10배 증가하였을 때, 차아염소산염 발생량이 800배 증가한 104.00±0.50 mg/L로 측정되었다. 이러한 결과는 전해질 농도가 높을수록 전극의 활성 면적당 Cl- 이온의 접촉량이 증가하게 되어 차아염소산염의 생성반응이 활성화된 것으로 해석된다. 이전에 수행된 다양한 반응표면분석법 실험 결과와 일치하며, 전해질 농도가 증가할수록 저항이 감소하여 염소계산화제 생산에 긍정적인 영향을 미치는 것으로 보고되었다[16]. 전기분해반응을 통한 환경오염물질 분해실험에서도 전기화학반응에서 NaCl 투입이 염소계 산화제 생성 반응을 유도할 뿐만 아니라[17], NaCl 농도증가가 염소계 산화제 생성량이 증가하였다는 보고가 있다[18]. 하지만, 수소 발생량은 전해질 농도의 영향이 없는 것으로 관찰되었다 (Fig. 5(B)). 외부전압인가 후 즉각적으로 수소발생이 측정되었고, 각 실험조건에서 7.55~7.61 mL/min의 범위에서 측정되었으며, 이 수치는 Fig. 3에서 본 것처럼 DI water일 때 발생한 수소 발생량과 큰 차이가 없었다.
또한, NaCl 5 g/L의 유량 조절을 통하여 반응시간을 증가시켰을 때, 차아염소산염의 발생량도 증가하였다. 본 연구에서는 1800초에 유량이 4배 감소시켜서 반응시간을 늘렸을 때, 차아염소산염 발생량이 2.3배 증가하여 36.10±0.27 mg/L로 측정되었다(Fig. 6(A)). 이러한 경향은 최근 연구 결과와 일치하지만, 본 연구결과에서는 반응시간이 증가함에 따라 생성효율의 상승률은 점차 감소하는 것으로 관찰되었다[16]. 또한, NaCl 농도 영향 실험 결과와 동일하게 유량에 따른 반응시간은 수소 발생량에 영향이 없는 것으로 관찰되었다(7.41~7.56 mL/min, Fig. 6(B)). 이 연구에서는 전기분해시 전류밀도가 효율에 미치는 영향을 고려하여 일정한 전류밀도로 유지하는 정전류 실험을 진행하였으며. 이로 인해 수전해로 생성되는 수소량이 일정 범위 내에서 유지되었다. 하지만, 일반적인 수전해 셀에선 전해질의 유량은 물질전달과 전극 표면 사이의 물질 이동에 영향을 줄 뿐만 아니라, concentration polarization, 전극 표면의 열방출 등과 관련이 있기 때문에 전해질 유량은 특정 수전해 운전조건에 따라 신중하게 제어할 필요가 있다.
4. 결 론본 연구는 MEA가 설치된 격막식 수전해 셀을 이용하여 동시에 차아염소산염과 수소를 생산하는 가능성을 조사하고, 이를 위해 Anolyte로 NaCl 전해질의 농도와 유량을 변화시킨 조건에서의 차아염소산염과 수소 생산 효율을 비교하였다. 수전해 기술은 난분해성 물질과 고농도 폐수를 처리하는 데 효과적으로 활용되며, 산업적으로 어려운 오염물질을 분해하는 데에도 적용될 수 있다. 또한, 전기화학적 수처리 기술은 환경 보호 및 경제성 측면에서 염소소독을 대체할 수 있는 새로운 솔루션으로 주목받고 있다. 이러한 관점에서 수소를 생산할 수 있는 PEM 수전해 기술을 활용하여 에너지 생산과 동시에 효율적인 소독제 생산 기술을 모색하였다.
1) MEA설치된 수전해 셀에서 Anolyte로 NaCl을 사용함으로써 차아염소산염 생성과 수소생산이 동시에 이루어지는 것을 확인하였다. 다만, Anolyte변경에 따른 전압증가는 후속연구를 통해 개선해야 할 것으로 보여진다.
2) 전해질의 농도를 1~10 g/L까지 증가시키며 실험한 결과 전해질의 농도와 염소계 산화제 발생량은 비례하였다.
3) 유량을 5~20 mL/min로 조절하여 반응시간이 증가할수록, 즉 유속이 느릴수록 염소계 산화제의 발생량은 증가하였다.
4) NaCl 농도와 유량이 다른 여러 실험조건에도 불구하고 전류밀도가 유지되었기 때문에 전해질 농도와 유량은 수소발생량에 크게 영향을 미치지 않는 것으로 관찰되었다.
Acknowledgments본 연구는 한국연구재단의 우수신진연구자지원사업(NRF2020R1C1C1007350)과 2021년도 정부(산업통상자원부)의 재원으로 한국에너지기술평가원의 지원을 받아 수행된 연구(20214000000090, 수소에너지산업 고도화 인력양성)입니다. 이에 감사드립니다.
NotesDeclaration of Competing Interest The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper. Fig. 2.(A) LSV experiment with DI water for evaluation of minimum required voltage of water electrolysis and (B) hydrogen production rate during LSV experiment. 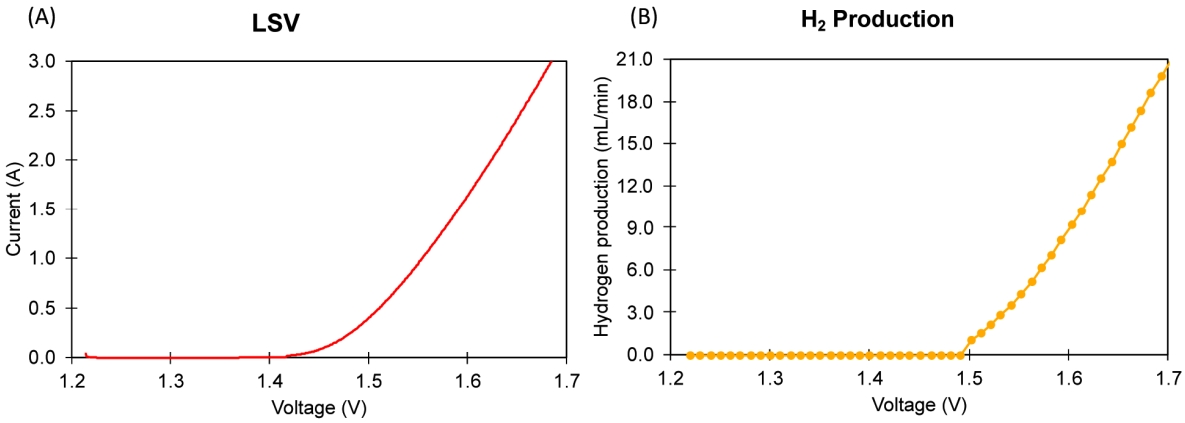
Fig. 3.Constant current experiment results using deionized water; (A) current and cell voltage and (B) hydrogen production. 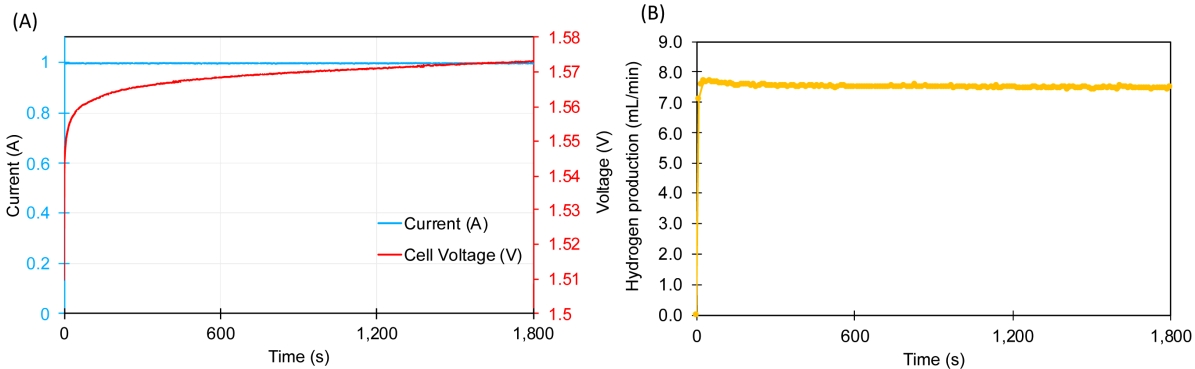
Fig. 4.Simultaneous hypochlorite and hydrogen production using a 2-compartment water electrolysis cell, which was installed with an MEA. Constant current experiments with 1 g/L of NaCl in the anolyte resulted in (A) current and cell voltage, and (B) hydroperoxide and hydrogen production. 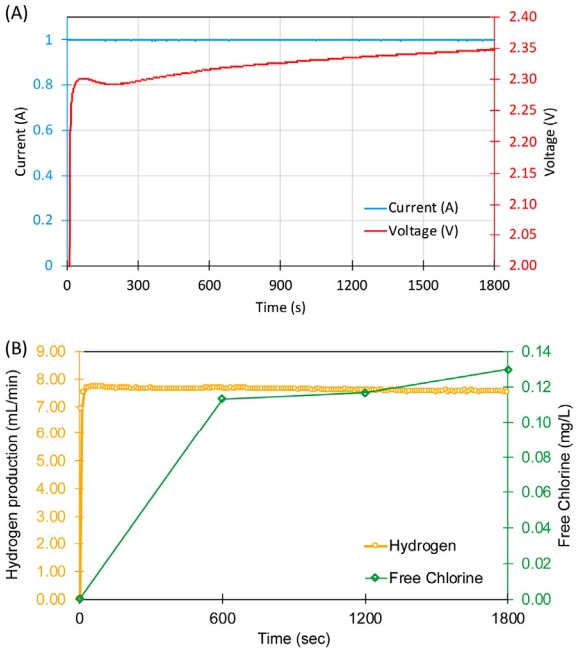
Fig. 5.A comparative analysis of the (A) free chlorine generation rate and (B) hydrogen production rate in response to varying NaCl concentrations as the anolyte. 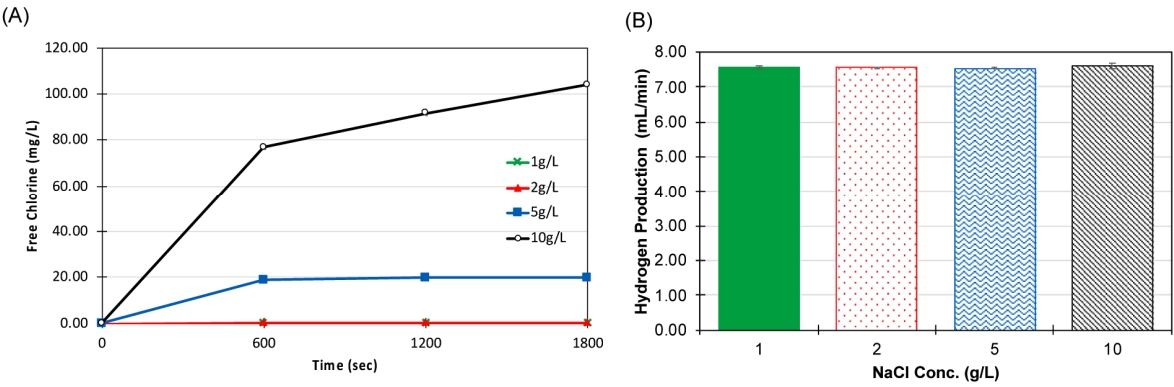
Fig. 6.A comparative analysis of the (A) free chlorine generation rate and (B) hydrogen production rate in response to different flow rates of the anolyte at a fixed NaCl concentration of 5 g/L. 
Table 1.Components of the PEM cell and the MEA utilized for Hydroperoxide and hydrogen generation. References1. S. A. Grigoriev, V. N. Fateev, D. G. Bessarabov, P. Millet, Current status, research trends, and challenges in water electrolysis science and technology, Int. J. Hydrogen Energy., 45(49), 26036-26058(2020).
2. S. Wang, A. Lu, C. J. Zhong, Hydrogen production from water electrolysis: role of catalysts, Nano Converg., 8(1), 4(2021).
3. S. Anwar, F. Khan, Y. Zhang, A. Djire, Recent development in electrocatalysts for hydrogen production through water electrolysis, Int. J. Hydrogen Energy., 46(63), 32284-32317(2021).
4. Jun. Chi, Hongmei. Yu, Water electrolysis based on renewable energy for hydrogen production, Chin. J. Catal., 39(3), 390-394(2018).
5. JH. Kim, DK. Park, JH. Kim, HJ. Kim, HS. Kim, SH. Kang, JH. Ryu, Trend of CO2 Free H2 Production Technology for Carbon Neutrality, Journal of Energy & Climate Change., 16(2), 103-127(2021).
6. S. S. Kumar, V. H, Hydrogen production by PEM water electrolysis–A review, Materials Science for Energy Technologies., 2(3), 442-454(2019).
7. J. Lee, J. Lee, S. Uhm, H. J. Lee, Electrochemical technologies: Water treatment, Appl. Chem. Eng., 22(3), 235-242(2011).
8. Y.-J. Liu, C.-Y. Hu, S.-L. Lo, Direct and indirect electrochemical oxidation of amine-containing pharmaceuticals using graphite electrodes, J. Hazard. Mater., 366, 592-605(2019).
9. N. Park, S. Yoon, S. Park, H. Yun, M. Yun, Y. Lee, A Study on the Optimal Management Technology of the On-site Sodium Hypochlorite Generator for Disinfection By-products Reduction, J Korean Soc Environ Eng., 44(12), 525-533(2022).
10. H. Shin, E. Lee, B. Jung, Localization Development of On-Site High Sodium Hypochlorite Generation, Trans. Korean Soc. Mech. Eng. C., 1(1), 83-90(2013).
11. Q. Feng, X.−Z. Yuan, G. Liu, B. Wei, Z. Zhang, H. Li, H. Wang, A review of proton exchange membrane water electrolysis on degradation mechanisms and mitigation strategies, J. Power Sources., 366, 33-55(2017).
12. T. Kim, J. Lee, G. Cho, K. Park, Degradation of Nafion Membrane by Oxygen Radical, Korean Chem. Eng. Res., 44(6), 597-601(2006).
13. J.-H. Jeong, E.-K. Shin, J.-J. Jeong, I.-C. Na, C.-H. Chu, K.-P. Park, Degradation of Electrode and Membrane in Proton Exchange Membrane Fuel Cell After Water Electrolysis, Korean Chem. Eng. Res., 52(6), 695-700(2014).
14. H. Cho, H. Shin, S. Ko, A Study on Control Disinfection By-products in High Sodium Hypochlorite Generation, Trans. Korean Soc. Mech. Eng. B., 41(3), 183-189(2017).
15. J. M. Kim, S. S. Hwang, C. G. Chang, Preparation and Characterization of Crosslinked Copolymer Membrane Containing Sulfonated Poly(ether sulfone) and p-Phenylene Terephthalamide Segments, Polymer(Korea)., 35(2), 106-112(2011).
16. J. Ju, C. Park, Application of Response Surface Methodology to Optimize the Performance of the Electro-Chlorination Process, J Environ Health Sci., 48(3), 167-175(2022).
|
|
||||||||||||||||||||||||||||||||||||