The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
생태독성시험을 위한 국내 자생생물 후보 목록 도출: (2) 토양시험종
Abstract
Ecotoxicity data that are used in ecological risk assessments are acquired based on the test conditions presented in international standard test methods. However, 58.5% of native organisms in Korea were assessed using international standard test methods. It is important to consider native organisms in Korea as test species, in terms of toxicity sensitivity, character of domestic environment, cost reductions, and ecological disturbance. In this study, we used the international taxonomic classification system (Kingdom Animalia, Plantae, Protista). We investigated the habitat (especially, soil) and analyzed the presence or absence of international standard test methods and Korean native organisms. In Animalia, 19 classes were derived from the soil environment. In total, 17 and 2 classes were derived from each criterion: ‘not included in standard test methods and identifiable Korean native organisms’ and ‘not included in Korean native organisms in standard test methods and identifiable Korean native organisms’, respectively. At this time, Class Chilopoda and Pauropoda were excluded. We verified the possible list for Korean native organisms (17 classes), based on Korean native species list, toxicity data, distribution, taxonomic, and ecological status. Therefore, we propose 4 Kingdom Animalia (Malacostraca, Diplura, Insecta, and Gastropoda), 9 Kingdom Plantae (Chlorophyceae, Trebouxiophyceae, Andreaeopsida, Bryopsida, Polytrichopsida, Sphagnopsida, Tetraphidopsida, Jungermanniopsida, Marchantiopsida), and 1 Protista (Euglenophyceae), as candidate list of Korean native organisms for soil ecotoxicity testing.
Key words: Domestic Species, Ecotoxicity, Soil Toxicity, Native Organisms
요약
생태위해성평가의 생태독성자료는 국제 표준시험법에 따른 결과를 활용해야하나, 생태독성 국제 표준시험법의 시험종 중 국내 서식종은 58.5%에 해당된다. 독성민감도, 국내 환경특성, 비용 절감, 생태계 교란 방지 등의 측면에서 국내 서식종을 고려할 필요가 있으나, 현재까지 국내 서식종을 이용한 생태독성실험방법 개발 및 표준화 작업은 기초 단계로, 국내 서식종에 대한 심화연구가 필요하다. 본 연구에서는 토양생태독성평가를 위한 국내 자생생물 후보 목록을 도출하기 위해, 국제생물분류체계 중 토양 서식 여부, 국제 토양생태독성 표준시험법의 해당 여부, 국내 서식 여부를 중심으로 국내 자생생물 후보를 선별하였으며, 국내 생물종 목록, 독성연구사례 여부, 분포성, 분류학적・생태학적 위치를 바탕으로 국내 자생생물 후보의 특성 현황을 분석하여 최종적으로 토양생태독성평가를 위한 국내 자생생물 후보 목록을 도출하였다. 이동성 동물계에 한 해 토양 서식 생물분류군 19개 강을 추출하였으며, 동물계, 식물계, 원생생물계를 대상으로 국제 토양생태독성 표준시험법의 해당 여부를 확인하였고, 표준시험법에 제시되지 않은 생물분류군 17개 강을 우선 선별하였다. 또한 표준시험법에 제시되었으나 국내 자생생물이 포함되지 않은 생물분류군 2개 강을 차선 선별하였다. 단, 해독 기능이 있는 순각강 및 국내 자생생물이 1종 뿐인 소각강, 총 2개 강을 제외하였다. 그리고 국내 생물종 목록, 독성연구사례 여부, 분포성, 분류학적・생태학적 위치를 통해 17개 강 모두 잠재적인 토양생태독성시험종으로서 가능성이 있는 것으로 파악되어, 최종적으로 동물계 7개 강(연갑강, 좀붙이강, 곤충강, 원미강, 배각강, 결합강, 복족강), 식물계 9개 강(녹조강, 트레보욱시아강, 검정이끼강, 선태식물강, 솔이끼강, 물이끼강, 네삭치이끼강, 망울이끼강, 우산이끼강), 원생생물계 1개 강(유글레나강)의 총 17개 강을 토양 생태독성시험을 위한 국내 자생생물 후보 목록으로 제안하였다.
주제어: 국내종, 생태독성, 토양독성, 자생생물
1. 서 론
생태위해성평가의 생태독성자료는 국제 표준시험법에 따른 결과를 활용해야하나[ 1], 토양생태독성 국제표준시험법의 106종(6개 문 또는 계, 8개 강) 중 국내 서식하는 생태독성시험종은 58.5%에 해당된다[ 2]. 그러나 국내 서식종인 Chlorococcum infusionum (물푸른알말), Daphnia galeata (유리물벼룩), Simocephalus mixtus (요술시모물벼룩)가 국외 서식종 Chlamydomonas reinhardtii, Daphnia magna, Ceriodaphnia dubia보다 독성 영향에 더 민감하다는 연구 결과[ 3~ 5]를 고려할 경우, 국내 생태위해성평가 시 생태독성자료의 시험종은 국내 서식 여부를 고려할 필요가 있다. 또한 국외 서식종의 수입 비용 절감, 국외 서식종의 생태계 교란[ 6, 7] 등의 측면에서 국내 서식종 활용이 적합하다고 볼 수 있다[ 8]. 기존 문헌 및 실험 연구를 통해 생태독성시험종으로서 국내 서식종 연구가 보고된 바 있으며[ 3, 9~ 11], 현재까지 톡토기류 Isotomurus palustris (늪마디톡토기) [ 9], Lobella sokamensis (꼬마혹무늬톡토기) [ 10], 토양조류 Chlorococcum infusionum (물푸른알말) [ 3, 11] 등의 토양생태독성시험종이 개발된 바 있다. 단, 생태독성시험종으로서 국내 서식종 연구는 기초적인 생태독성실험방법 개발 및 표준화 단계이므로, 생태위해성평가 시 활용 가능한 정량적인 국내 서식종의 생태독성자료 축적이 미진한 실정이다. 따라서 다양한 생물분류군에 속하는 국내 서식 토양생태독성시험종을 활용하여 토양생태독성실험방법의 개발 및 표준화를 통해서, 국내 서식 토양생태독성시험종을 이용한 정량적 생태독성자료를 생성함으로써, 국제적으로 신뢰성있는 국내 서식 토양생태독성 시험종 확보가 가능할 것으로 사료된다. 본 연구에서는 토양생태독성평가를 위한 국내 자생생물 후보 목록을 도출하기 위해, 국제생물분류체계(동물계, 식물계, 원생생물계) 내 토양 서식성, 국제적인 토양생태독성표준시험법의 해당 여부, 국내 서식성을 중심으로 국내 자생생물 후보를 선별하였으며, 국내 생물종 목록, 독성연구 사례 여부, 분포성, 분류학적・생태학적 위치를 바탕으로 국내 자생생물 후보의 특성 현황을 분석하여 최종적으로 토양생태독성시험을 위한 잠재적인 국내 자생생물 후보 목록을 도출하였다.
2. 연구 방법
토양생태독성평가를 위한 국내 자생생물 후보 목록을 도출하기 위해, 국제생물분류체계를 바탕으로 토양 서식성(동물계에 한함)을 고려하였으며, 토양생태독성 국제표준시험법의 해당 여부, 국내 자생생물 유무를 파악하였다. 국제생물분류체계(예: Kingdom, Phylum 또는 Division, Class)는 국립생물자원관 국가생물종목록[ 12]과 미국, 캐나다, 멕시코 정부 연합으로 제공된 통합분류학정보시스템(Integrated Taxonomic Information System, ITIS) [ 13]을 활용하였으며, 동물계의 토양 서식성은 국립수목원의 국가생물종지식정보시스템[ 14], 국립생물자원관의 한반도생물자원포털[ 15]을 활용하였다. 또한 추출된 생물분류군(강) 중 토양생태독성 국제표준시험법에 포함되지 않은 생물분류군(강)을 우선 선별하였으며, 토양생태독성 국제표준시험법에 제시되었으나 국내 자생생물이 포함되지 않은 생물분류군(강)을 차선 선별하였다. 토양생태독성 국제표준시험법은 경제협력개발기구(Organization for Economic Cooperation and Development, OECD) [ 16~ 22], 미국재료시험협회(American Society for Testing and Materials, ASTM) [ 23~ 25], 국제표준화기구(International Organization for Standardization, ISO) [ 26~ 39], 미국환경부(U.S. Environmental Protection Agency, USEPA) [ 40~ 43]을 활용하였다. 국내 자생생물 유무는 국가생물종지식정보시스템[ 14], 한반도생물자원포털[ 15], 정부보고서[ 44], 학술논문[ 2, 3, 10, 11, 45]을 활용하였다. 한편 최종 도출된 토양생태독성평가를 위한 국내 자생생물 후보 특성을 분석하기 위해, 국가생물종지식정보시스템[ 14], 한반도생물자원포털[ 15], 정부보고서[ 44], 학술논문[ 2, 3, 10, 11, 45]을 활용하여 국내 생물종 목록, 독성연구사례 여부, 분포성, 분류학적・생태학적 위치를 파악하였다.
3. 결과 및 고찰
3.1. 생물분류체계 기반 토양생태독성평가를 위한 국내 자생생물 후보 목록 도출
동물계(Kingdom Animalia) 34개 문 101개 강, 식물계(Kingdom Plantae) 8개 문 42개 강, 원생생물계(Kingdom Protista) 6개 문 18개 강 중 토양 서식성은 19개 강으로 확인되었다( Table 1). 동물계 19개 강, 식물계 42개 강( Table 2), 원생생물계 18개 강( Table 3) 중 OECD [ 16~ 22], ASTM [ 23~ 25], ISO [ 26~ 39], USEPA [ 40~ 43]의 토양생태독성 국제표준시험법에 포함되지 않으며, 국내 자생생물 목록 확인이 가능한 생물분류군은 동물계 7개 강(연갑강, 좀붙이강, 원미강, 순각강, 배각강, 소각강, 결합강), 식물계 9개 강(녹조강, 트레보욱시아강, 검정이끼강, 선태식물강, 솔이끼강, 물이끼강, 네삭치이끼강, 망울이끼강, 우산이끼강), 원생생물계 1개 강(유글레나강)으로 확인되었다. 또한 토양생태독성 국제표준시험법에 제시되었으나 국내 자생생물이 포함되지 않은 생물분류군은 동물계 2개 강(곤충강, 복족강)으로 확인되었다. 단, 순각강은 해독연구 사례가 많아[ 46~ 49] 독성민감도 낮을 것으로 예상되며, 소각강은 국내 자생생물 1종만 보고되어[ 12] 개발 가능한 시험종이 제한적이므로, 국내 자생생물 후보 목록 도출에서 제외하였다. 따라서 최종적으로 동물계 7개 강(연갑강, 좀붙이강, 곤충강, 원미강, 배각강, 결합강, 복족강), 식물계 9개 강(녹조강, 트레보욱시아강, 검정이끼강, 선태식물강, 솔이끼강, 물이끼강, 네삭치이끼강, 망울이끼강, 우산이끼강), 원생생물계 1개 강(유글레나강)의 총 17개 강을 토양생태독성시험을 위한 국내 자생생물 후보 목록으로 도출하였다( Table 4, Fig. 1).
3.2. 토양생태독성시험을 위한 국내 자생생물 후보의 특성 현황 분석
3.2.1. 연갑강
연갑강 중 등각목은 토양생물 중 공벌레, 쥐며느리, 부채벌레 등을 포함하며, 부채벌레과 1종, 모래무지쥐며느리과 1종, 마디벌레과 4종, Arcturidae 1종, 남방공벌레과 3종, 물벌레과 2종, 십각기생과 12종, 두엽벌레과 1종, 모래무지벌레과 5종, 갈고리벌레과 2종, 큰턱벌레과 1종, 주걱벌레과 19종, Ionidae 1종, 물좀벌레과 11종, 갯강구과 3종, Limnoriidae 1종, Oniscidae 2종, 오목꼬리마디벌레과 2종, 남방쥐며느리과 3종, 양쥐며느리과 4종, 세갈래쥐며느리과 5종, 잔벌레과 20종, 쥐며느리과 7종, 갯쥐며느리과 1종의 총 112종의 국내 자생종이 확인되었다[ 12]. 기존 공벌레, 쥐며느리 관련 표준시험법은 제시되어 있지 않으나, 카드뮴, 구리, 납, 벤조에이피렌, 철, 망간, 코발트 등에 대해 7~112일 동안 치사, 성장, 먹이 소비량, 생식, 호흡 등의 독성 영향이 평가된 바 있다[ 50~ 52]. 등각류는 낙엽, 토양 부식질, 동물 사체 섭취, 분해[ 52~ 54], 먹이와 토양을 통한 중금속과 유기화합물 축적에 관여하는 것으로 알려져 있으며[ 53~ 56], 양쥐며느리과는 1년에 2번 이상 번식한다[ 53].
3.2.2. 좀붙이강
좀붙이강은 좀붙이목의 5종( Campodea ishii (좀붙이), C. staphylinus (긴두꼬리벌레), Metriocampa matsumurai (꼬마좀붙이), Japyx beneserratus (큰집게두꼬리벌레), J. japonicus (집게두꼬리벌레))이 국내 자생종으로 보고되었으며[ 12], 중금속(Cd, Cu, Pb, Zn, Fe, Mn) 흡수에 따른 Campodea quilisi의 중장 및 말피기관돌기 세포 영향이 평가된 바 있다[ 57]. 좀붙이류는 토양, 낙엽, 돌 밑 등 습도가 높은 곳에 분포하며[ 58], 눈과 날개 없이 체장 5 mm의 작은 체절로 형성되어 있다[ 58, 59].
3.2.3. 곤충강
곤충강은 딱정벌레목, 집게벌레목, 바퀴목 등 총 25목 17,293종이 국내 자생종으로 보고되었으며, 소똥구리과는 꼬마소똥구리류, 소똥구리류, 소똥풍뎅이류 등의 35종으로 보고된 바 있다[ 12]. 소똥구리과 관련 생태독성연구는 수의약품에 대한 21일 후 Aphodius constans 유충의 생존, 크기, 색깔, 형태 변화가 보고된 바 있으며[ 60], 35일 후 Onthophagus landolti의 똥 제거, 치사, 번식, 알이 성충이 되는 비율이 보고된 바 있다[ 61, 62]. 소똥구리과는 식분성 곤충으로, 유기 물질을 물리적으로 재배치하여 상부 토양층에 미생물 및 화학 변화를 일으켜 영양소 순환에 기여하고, 토양 폭기 및 수분다공성을 증가시켜 토양 생물군과 식물 생산성에 영향을 미친다[ 63].
3.2.4. 원미강
원미강은 미소절지동물을 포함하며[ 64], 낫발이목 낫발이과 및 옛낫발이과 24종이 국내 자생종으로 보고된 바 있다[ 12]. 낫발이 관련 생태독성연구는 전무한 것으로 나타났으나, 낙엽, 토양층에 분포하는 것으로 알려져 있다[ 65]. 체장 0.5~2.5 mm로, 눈, 날개, 더듬이가 없으며[ 65], 환경 습도에 따라 표피 색깔 및 강도가 상이하다[ 66]. 발생단계는 egg, prelarva, larva I, larva II, maturus junior, preimago, imago 순으로 성장하는 것으로 알려져 있다[ 65, 66].
3.2.5. 배각강
배각강은 노래기로 불리며, 갈퀴노래기목 22종이 국내 자생종으로 보고된 바 있다[ 12]. 노래기 관련 생태독성연구는 수은, 다방향족탄화수소에 대한 7~90일 후 Trigoniulus corallinus, Rhinocricus padbergi, Rhinocricus padbergi의 치사, 행동변화, 변색 등의 영향이 보고된 바 있다[ 67~ 70]. 노래기는 낙엽, 토양 상층에 분포하면서 암석 물질, 유기 물질, 낙엽, 과일, 이끼 등을 섭취하며, 유기물 분해, 광물화 촉진, 토양 비옥화, 미생물 군집 등에 영향을 미치는 것으로 알려져 있다[ 67, 69].
3.2.6. 결합강
결합강은 다지류 중 가장 작은 강으로, 애지네와 동양애지네 2종이 국내 자생종으로 보고된 바 있다[ 12]. 애지네 관련 생태독성연구는 살충제에 대한 3일 후 Scutigerella immaculata의 치사 영향이 보고된 바 있으며[ 71], 유기물이 풍부한 습한 토양에 주로 서식하는 것으로 알려져 있다[ 72]. 식물 뿌리, 유기물, 토양 곰팡이 등을 섭취하며[ 71, 73], 토양 온도가 2~28℃의 저온과 고온에서 생존한다고 알려져 있다[ 72].
3.2.7. 복족강
복족강 중 토양 달팽이류는 나뭇잎, 줄기와 같은 수목, 낙엽과 나무 밑의 토양에서 분포하며[ 74], 배꼽달팽이류 14종이 국내 자생종으로 보고된 바 있다[ 12]. 토양 달팽이류 관련 생태독성연구는 ISO에 제시된 표준시험종으로 국외종인 Helix aspersa가 있으며[ 32], 노출 3~28일 후 Cantareus aspersus, Hatina fulica, Eobania vermiculata, Theba pisana, Bradybaena similaris, Helix vermiculata의 부화, 먹이, 효소활성, DNA 손상, 생존, 생식, 생물농축 등 독성 영향이 평가된 바 있다[ 75~ 78].
3.2.8. 녹조강
녹조강의 국내 자생종은 Chlorococcum, Chlamydomonas 등의 517종으로 보고되었으며[ 12], 녹조강 관련 생태독성연구는 노출 6일 후 중금속 및 은나노물질 처리 토양에서 Chlorococcum infusionum, Chlamydomonas reinhardtii의 성장, 광합성활성, 세포형태, 효소활성, 산화스트레스, 세포막투과성 영향이 평가된 바 있다[ 3, 11]. Chlorococcum, Chlamydomonas는 토양 우점종인 것으로 알려져 있으며[ 79], 토양 표층 및 차표층에 서식하며 생산자이자 먹이원 역할을 한다[ 80].
3.2.9. 트레보욱시아강
트레보욱시아강 중 클로렐라목 112종 및 트레보욱시아목 5종은 국내 자생종으로 보고되었으며[ 12], 클로렐라는 토양우점종인 것으로 알려져 있고[ 79], 토양환경의 표층 및 차표층에 서식하면서 생태계 내 주요 생산자이자 중형동물 및 소형동물의 먹이원 역할을 하며[ 80], 유기물 합성이나 점질성 협막 형성을 통해 토양 비옥화 및 응집화 현상에 기여하는 것으로 알려져 있다[ 81]. 클로렐라 관련 생태독성연구는 중금속 오염토양에서 추출한 Chlorella sp.를 이용하여 생물농축 영향이 보고된 바 있다[ 82].
3.2.10. 검정이끼강
검정이끼강의 국내 자생종은 검정이끼목 검정이끼과 Andreaea rupestris (검정이끼)와 옥구슬이끼과 Oedipodium griffithianum (옥구슬이끼) 총 2종이 보고되었다[ 12]. 검정이끼류는 규질암에서 주로 서식하는 이끼로, 검붉으며 부서지기 쉽고 길이가 짧다. 잎은 두꺼운 하나의 세포로 되어 있으나, 일부 종은 중앙에 여러 세포가 밀집하여 주맥을 형성한다. 줄기는 색깔이 있는 세포벽으로 되어 있으며, 대부분의 이끼와는 달리 엽상체에서 원사체가 생긴다[ 83]. 검정이끼강 관련 생태독성연구는 전무한 것으로 나타났다.
3.2.11. 선태식물강
선태식물강은 참이끼목 65종, 새우이끼목 1종, 꼬리이끼목 15종, 방울이끼목 8종, 미기재 목 36과 477종의 총 566종 국내 자생종이 보고된 바 있으며, 생태독성시험종으로 사용된 바 있는 털깃털이끼류는 털깃털이끼과 48종, 털깃털이끼속 18종이 보고되었다[ 12]. 선태식물강 관련 생태독성연구는 Plagiomnium cuspidatum (들덩굴초롱이끼), Hypnum plumaeforme (털깃털이끼), Thuidium cymbifolium (물가깃털이끼), Brachythecium piligerum이 적용된 바 있으며, 중금속을 대상으로 노출 2~30일 후 엽록소, 안토시아닌, 수분, 단백질, 효소활성, 유전자발현 영향이 보고된 바 있다[ 84~ 87].
3.2.12. 솔이끼강
솔이끼강의 국내 자생종은 솔이끼목 솔이끼과 25종이 보고되었으나[ 12], 솔이끼강 관련 생태독성학적 연구는 전무한 것으로 나타났다. 암수딴그루이거나 암수한그루로 포자낭은 항아리 모양으로 큰 편이고 삭병의 길이가 길며, 포자낭의 입구를 덮는 원반 같은 구막이 있다. 포자낭 보호조직인 calypra는 크고 표면에는 털이 나 있다. 기둥모양의 삭추가 있으며, 삭치는 최소 16개로 갈라진다. 포엽은 컵 모양의 구조를 이루고 빗방울이 컵에 떨어지면 무성아나 정자가 튀어 나온다[ 83, 88~ 90]. 헛뿌리는 물의 수송을 촉진시키고 배우체를 고정하는 역할을 하며[ 83], 잎은 이산화탄소 흡수와 광합성효율을 증가시키기 위해 엽신에 박막세포로 된 헛엽육을 형성한다[ 90]. 다른 이끼류와는 달리 잎의 표면에 왁스로 된 큐티클층이 있어 층간공간으로 물이 침투하는 것을 막아 고등식물과 유사하다[ 83, 90].
3.2.13. 물이끼강
물이끼강의 국내 자생종은 물이끼목 20종으로 보고되었으며[ 12], 탄소를 고정하여 토탄을 만들어 내어 토탄습지를 형성하며[ 91, 92], 뿌리가 없고 잎이 단층세포 구조로 되어 있어 환경에 직접 반응하는 것으로 보고되었다[ 93]. 생태독성연구는 중금속을 대상으로 노출 10~25일 후 국내 자생종인 Sphagnum squarrosum (비늘물이끼)의 엽록소, 단백질, 질소, 탄수화물, 프롤린, 효소활성 영향이 평가된 바 있다[ 94, 95].
3.2.14. 네삭치이끼강
네삭치이끼강은 Tetraphis pellucida (네삭치이끼) 1종이 국내 자생종으로 보고된 바 있으며[ 12], 삭치가 큰 4갈래로 깊게 완전히 갈라져 명명되었다. 네삭치이끼는 높이가 8~18 mm이고, 무성생식을 하며, 컵모양의 화탁에서 원반모양의 무성아가 형성된다[ 96]. 네삭치이끼강 관련 생태독성연구는 전무한 것으로 나타났다.
3.2.15. 망울이끼강
망울이끼강은 망울이끼목 133종, 리본이끼목 11종, 세줄이끼목 89종, 털잎이끼목 3종, 미기재 목 45종의 총 281종이 국내 자생종으로 보고되었으며[ 12], 망울이끼목의 대부분은 육생하는 것으로 알려져 있다[ 97]. 국내 자생하는 엄마이끼류는 13종이며, Scapania sphaerifera (바위엄마이끼)는 길이 2~2.5 mm, 직경 10~20 mm의 녹갈색을 띤다. 외피세포는 2~3층의 두꺼운 갈색 세포벽으로 형성되어 있으며, 적갈색의 윗줄기, 흑살색의 아랫줄기, 무색의 헛뿌리를 가진다. 지방체는 한 세포에 4~6개가 있고, 특수화된 무석생식을 한다[ 98]. 망울이끼강 관련 생태독성연구는 중금속에 대한 15분 노출 후 Ptychanthus striatus의 엽록소 영향이 평가된 바 있다[ 99].
3.2.16. 우산이끼강
우산이끼강의 엷은잎우산대이끼목 1종, 우산이끼목 25종으로 보고되었고[ 12], 우산이끼목 중에서 둥근이끼과는 담수와 토양에서 서식하는 것으로 알려져 있으며[ 100, 101], 토양에서 서식하는 둥근이끼류는 보통 토성이 무른 진흙에서 서식하며, 건조하거나 반건조한 맨땅, 잔디밭 등에서도 발견되며, 토양 표면에 넓게 펼쳐진 로제타형으로 자란다[ 100]. 우산이끼류 관련 생태독성연구는 카드뮴에 대한 노출 14~30일 후 Lunularia cruciata의 성장, 무성아 발달, 노출 5일 후 Ricciocarpos natans (은행이끼)의 엽록소와 항산화효소 영향이 평가된 바 있다[ 102, 103].
3.2.17. 유글레나강
유글레나강의 국내 자생종은 유글레나과 236종으로 보고되었으며[ 12], 유글레나는 빛이 있는 곳에서는 녹색으로 광합성과 자가영양을 하며, 빛이 없는 곳에서는 무색으로 종속영양을 한다[ 104]. 유글레나는 무성생식을 하며[ 105], 성장 속도가 빠르고 실험실 내에서 배양이 용이하다[ 106, 107]. 유글레나 관련 생태독성연구는 대부분 국내 자생종인 Euglena gracilis가 사용되고 있으며, 중금속, 농약에 대한 노출 2~7일 후 엽록소, 광합성률, 운동성, 유영속도, 세포모양, 효소활성 영향이 평가된 바 있다[ 105~ 113].
4. 결 론
본 연구에서는 토양 생태독성평가를 위한 국내 자생생물 후보 목록을 도출하기 위해, 국제생물분류체계(동물계, 식물계, 원생생물계)를 조사하였으며, 이동성 동물계에 한해 토양 서식 생물분류군 19개 강을 추출하였다. 또한 3개 계를 대상으로 국제적인 토양생태독성 표준시험법의 해당 여부를 확인하였고, 표준시험법에 제시되지 않은 생물분류군 17개 강을 우선 선별하였으며, 표준시험법에 제시되었으나 국내 자생생물이 포함되지 않은 생물분류군 2개 강을 차선 선별하였다. 이 때 해독연구 사례가 많아 독성민감도 낮을 것으로 예상되는 순각강 및 국내 자생생물이 1종뿐인 소각강을 제외하고, 최종적으로 동물계 7개 강(연갑강, 좀붙이강, 곤충강, 원미강, 배각강, 결합강, 복족강), 식물계 9개 강(녹조강, 트레보욱시아강, 검정이끼강, 선태식물강, 솔이끼강, 물이끼강, 네삭치이끼강, 망울이끼강, 우산이끼강), 원생생물계 1개 강(유글레나강)의 총 17개 강을 토양 생태독성평가를 위한 국내 자생생물 후보 목록으로 도출하였다. 또한 국내 자생생물 후보의 특성 현황을 분석하기 위해, 국내 생물종 목록, 독성연구사례 여부, 분포성, 분류학적・생태학적 위치를 조사한 결과, 17개 강 모두 국내 생물종 목록 및 분포성이 확인되었고, 분류학적・생태학적 주요 위치를 차지하는 것으로 나타났으며, 일부 독성연구사례가 보고된 것으로 확인되었으므로, 17개 강 모두 잠재적인 토양 생태독성시험종으로서 가능성이 있는 것으로 파악되었다. 단, 생태독성시험종의 배양성 및 번식성은 실험 조건에 따라 상이하므로, 추후 국내 자생생물 후보 목록에 대한 장기실험연구를 통해 실험적용성을 평가할 필요가 있다.
Acknowledgments
본 연구는 정부(환경부)의 재원으로 국립생물자원관의 지원을 받아 수행하였음(NIBR201830201). This research was J. Korean Soc. Environ. Eng. 187 생태독성시험을 위한 국내 자생생물 후보 목록 도출: (2) 토양시험종 대한환경공학회지 제41권 제4호 2019년 4월 also supported by the Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Science, ICT and future planning (2016-R1A2B3010445)
Fig. 1.
Flow chart for deriving potential Korean native organisms to develop soil ecotoxicity test. 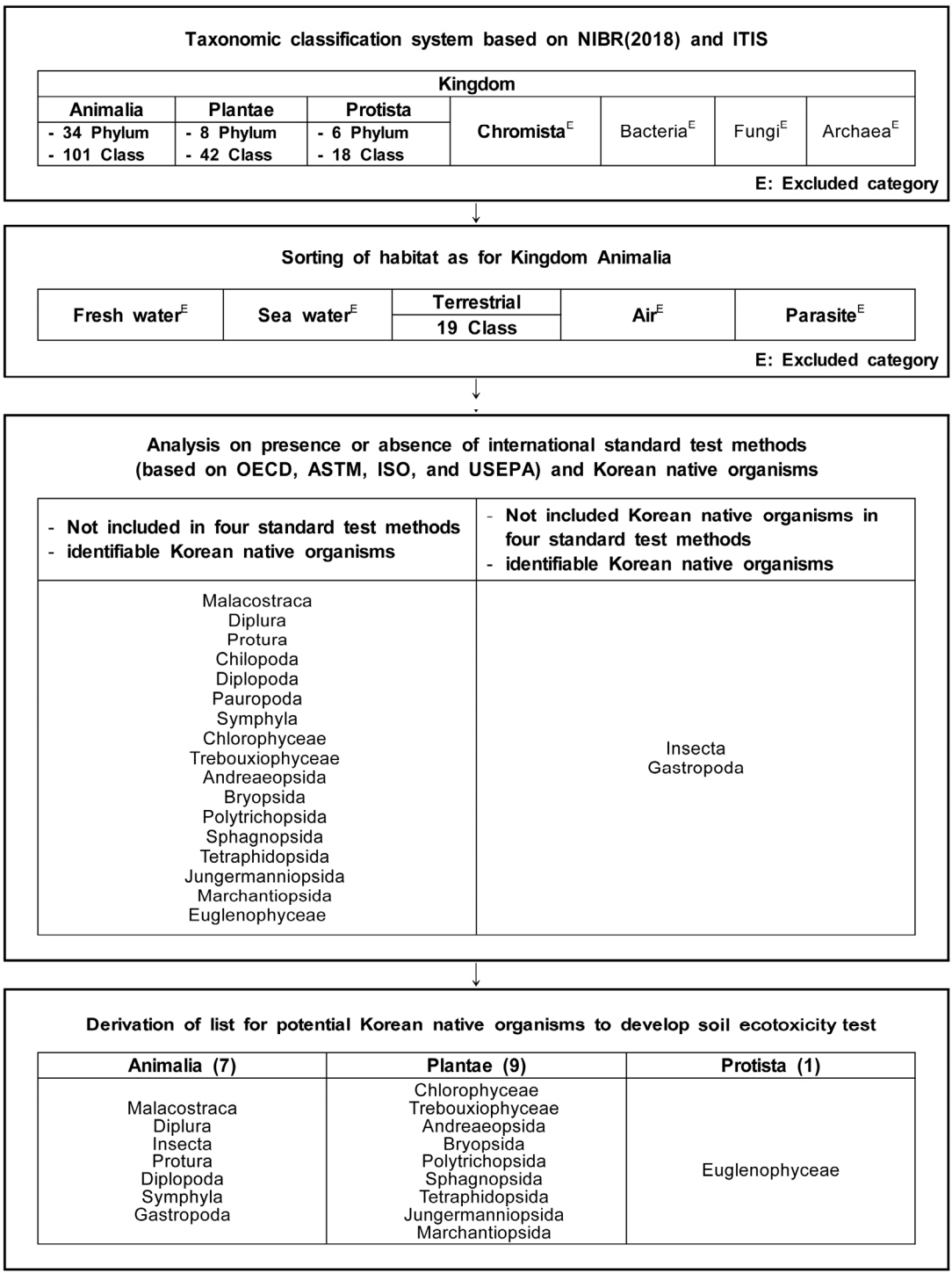
Table 1.
List for potential Korean native organisms to develop soil ecotoxicity test based on taxonomic classification - Kingdom Animalia
Taxonomic classification
|
Standard of selection
|
|
Phylum |
Class |
Habitat*
|
Existence of international standard test methods
|
|
Organization |
Inclusion of Korean native species |
|
Myxozoa |
- |
P |
- |
- |
|
Chordata |
Appendicularia |
SW |
- |
- |
|
Ascidiacea |
SW |
- |
- |
|
Thaliacea |
SW |
- |
- |
|
Cephalaspidomorphi |
SW |
- |
- |
|
Myxini |
SW |
- |
- |
|
Pteraspidomorphi |
Extinction |
|
Chondrostei |
SW |
- |
- |
|
Cladistei (=Cladistia) |
SW |
- |
- |
|
Holostei |
SW |
- |
- |
|
Teleostei |
FW, SW |
- |
- |
|
Chondrichthyes |
SW |
- |
- |
|
Coelacanthi |
SW |
- |
- |
|
Dipnoi |
FW |
- |
- |
|
Amphibia |
FW |
- |
- |
|
Aves |
T, A |
- |
- |
|
Mammalia |
SW, T |
- |
- |
|
Reptilia |
FW, SW, T |
- |
- |
|
Echinodermata |
Asteroidea |
SW |
- |
- |
|
Ophiuroidea |
SW |
- |
- |
|
Somasteroidea |
Extinction |
- |
- |
|
Crinoidea |
SW |
- |
- |
|
Echinoidea |
SW |
- |
- |
|
Holothuroidea |
SW |
- |
- |
|
Hemichordata |
Enteropneusta |
SW |
- |
- |
|
Pterobranchia |
SW |
- |
- |
|
Xenacoelomorpha |
Acoela |
FW, SW, T, P |
- |
- |
|
Nemertodermatida |
SW |
- |
- |
|
Chaetognatha |
Archisagittoidea |
SW |
- |
- |
|
Sagittoidea |
SW |
- |
- |
|
Arthropoda |
Arachnida |
T |
OECD |
O |
|
Merostomata |
SW |
- |
- |
|
Pycnogonida |
SW |
- |
- |
|
Branchiopoda |
FW |
- |
- |
|
Cephalocarida |
SW |
- |
- |
|
Malacostraca |
FW, SW, T |
- |
- |
|
Maxillopoda |
FW, SW |
- |
- |
|
Ostracoda |
FW, SW |
- |
- |
|
Remipedia |
SW |
- |
- |
|
Collembola |
T |
OECD, ISO |
O |
|
Arthropoda (continued) |
Diplura |
T |
- |
- |
|
Insecta |
FW, T, A |
ISO |
X |
|
Protura |
T |
- |
- |
|
Chilopoda |
T |
- |
- |
|
Diplopoda |
T |
- |
- |
|
Pauropoda |
T |
- |
- |
|
Symphyla |
T |
- |
- |
|
Kinorhyncha |
- |
SW |
- |
- |
|
Loricifera |
- |
SW |
- |
- |
|
Nematoda |
Chromadorea |
FW, SW, T |
ASTM |
X |
|
Dorylaimea |
- |
- |
- |
|
Enoplea |
FW, SW |
- |
- |
|
Nematomorpha |
- |
FW, SW |
- |
- |
|
Onychophora |
Udeonycophora |
T |
- |
- |
|
Priapulida |
- |
SW |
- |
- |
|
Tardigrada |
Eutardigrada |
FW, SW |
- |
- |
|
Heterotardigrada |
SW, T |
- |
- |
|
Mesotardigrada |
- |
- |
- |
|
Annelida |
Clitellata |
FW, SW, T |
OECD, ASTM, ISO, USEPA |
O |
|
Polychaeta |
FW, SW |
- |
- |
|
Brachiopoda |
Craniata |
SW |
- |
- |
|
Lingulata |
- |
- |
- |
|
Rhynchonellata |
SW |
- |
- |
|
Bryozoa |
Gymnolaemata |
SW |
- |
- |
|
Phylactolaemata |
FW, SW |
- |
- |
|
Stenolaemata |
SW |
- |
- |
|
Kamptozoa |
Cycliophora |
SW |
- |
- |
|
Entoprocta |
FW, SW |
- |
- |
|
Mollusca |
Bivalvia |
FW, SW |
- |
- |
|
Caudofoveata |
SW |
- |
- |
|
Cephalopoda |
SW |
- |
- |
|
Gastropoda |
FW, SW, T |
ISO |
X |
|
Monoplacophora |
SW |
- |
- |
|
Polyplacophora |
SW |
- |
- |
|
Scaphopoda |
SW |
- |
- |
|
Solenogastres |
SW |
- |
- |
|
Nemertea |
Anopla |
SW |
- |
- |
|
Enopla |
SW |
- |
- |
|
Phoronida |
- |
SW |
- |
- |
|
Sipuncula |
Phascolosomatidea |
SW |
- |
- |
|
Sipunculidea |
SW |
- |
- |
|
Acanthocephala |
Archiacanthocephala |
P |
- |
- |
|
Eoacanthocephala |
P |
- |
- |
|
Palaeacanthocephala |
P |
- |
- |
|
Polyacanthocephala |
- |
- |
- |
|
Gastrotricha |
- |
FWS, SWS |
- |
- |
|
Gnathostomulida |
- |
SW |
- |
- |
|
Micrognathozoa |
Micrognathozoa |
- |
- |
- |
|
Orthonectida |
- |
P |
- |
- |
|
Platyhelminthes |
Cestoda |
P |
- |
- |
|
Trematoda |
P |
- |
- |
|
Macrostomorpha |
- |
- |
- |
|
Trepaxonemata (=Turbellaria) |
FW |
- |
- |
|
Rhombozoa |
- |
P |
- |
- |
|
Rotifera |
Bdelloidea |
FW |
- |
- |
|
Monogonta (=Monogononta) |
FW, SW |
- |
- |
|
Pararotatoria |
- |
- |
- |
|
Cnidaria |
Anthozoa |
SW |
- |
- |
|
Cubozoa |
SW |
- |
- |
|
Hydrozoa |
FW, SW |
- |
- |
|
Polypodiozoa |
P |
- |
- |
|
Scyphozoa |
SW |
- |
- |
|
Staurozoa |
SW |
- |
- |
|
Malacosporea |
P |
- |
- |
|
Myxosporea |
P |
- |
- |
|
Ctenophora |
Nuda |
SW |
- |
- |
|
Tentaculata |
SW |
- |
- |
|
Placozoa |
- |
SW |
- |
- |
|
Porifera |
Calcarea |
SW |
- |
- |
|
Demospongiae |
FW, SW |
- |
- |
|
Hexactinellida |
SW |
- |
- |
|
Homoscleromorpha |
SW |
- |
- |
Table 2.
List for potential Korean native organisms to develop soil ecotoxicity test based on taxonomic classification - Kingdom Plantae
Taxonomic classification
|
Standard of selection
|
|
Division |
Class |
Existence of international standard test methods
|
|
Organization |
Inclusion of Korean native species |
|
Glaucophyta |
Glaucophyceae |
- |
- |
|
Rhodophyta |
Cyanidiophyceae |
- |
- |
|
Bangiophyceae |
- |
- |
|
Florideophyceae |
- |
- |
|
Compsopogonophyce |
- |
- |
|
Porphyridiophyceae |
- |
- |
|
Rhodellophyceae |
- |
- |
|
Stylonematophyceae |
- |
- |
|
Chlorophyta |
Chlorodendrophycea |
- |
- |
|
Chlorophyceae |
- |
- |
|
Pedinophyceae |
- |
- |
|
Trebouxiophyceae |
- |
- |
|
Ulvophyceae |
- |
- |
|
Mamiellophyceae |
- |
- |
|
Nephrophyceae |
- |
- |
|
Pyramimonadophyce |
- |
- |
|
Charophyta |
Charophyceae |
- |
- |
|
Chlorokybophyceae |
- |
- |
|
Coleochaetophyceae |
- |
- |
|
Conjugatophyceae |
- |
- |
|
Klebsormidiophyceae |
- |
- |
|
Mesostigmatophyceae |
- |
- |
|
Anthocerotophyta |
Anthocerotopsida |
- |
- |
|
Leiosporocerotopsida |
- |
- |
|
Bryophyta |
Andreaeobryopsida |
- |
- |
|
Andreaeopsida |
- |
- |
|
Bryopsida |
- |
- |
|
Oedipodiopsida |
- |
- |
|
Polytrichopsida |
- |
- |
|
Sphagnopsida |
- |
- |
|
Takakiopsida |
- |
- |
|
Tetraphidopsida |
- |
- |
|
Marchantiophyta |
Haplomitriopsida |
- |
- |
|
Jungermanniopsida |
- |
- |
|
Marchantiopsida |
- |
- |
|
Tracheophyta |
Lycopodiopsida |
- |
- |
|
Polypodiopsida |
- |
- |
|
Cycadopsida |
- |
- |
|
Ginkgoopsida |
- |
- |
|
Gnetopsida |
- |
- |
|
Magnoliopsida |
OECD, ASTM, ISO, USEPA |
O |
|
Pinopsida |
- |
- |
Table 3.
List for potential Korean native organisms to develop soil ecotoxicity test based on taxonomic classification - Kingdom Protista
Taxonomic classification
|
Standard of selection
|
|
Phylum |
Class |
Existence of international standard test methods
|
|
Organization |
Inclusion of Korean native species |
|
Apicomplexa |
Conoidasida |
- |
- |
|
Ciliophora |
Ciliatea |
- |
- |
|
Craspedophyta |
Craspedophyceae |
- |
- |
|
Euglenophycota |
Euglenophyceae |
- |
- |
|
Protozoa |
Acantharia |
- |
- |
|
Acrasea |
- |
- |
|
Eumycetozoa |
- |
- |
|
Labyrinthulea |
- |
- |
|
Haplosporea |
- |
- |
|
Heliozoa |
- |
- |
|
Sporozoa |
- |
- |
|
Filosia |
- |
- |
|
Granuloreticulosea |
- |
- |
|
Lobosa |
- |
- |
|
Xenophyophorida |
- |
- |
|
Sarcomastigophora |
Opalinata |
- |
- |
|
Phytomastigophora |
- |
- |
|
Zoomastigophora |
- |
- |
Table 4.
Final list for potential Korean native organisms to develop soil ecotoxicity test based on domestic species, status in ecosystem, and prior ecotoxicity data
Taxonomic classification
|
Standard of selection
|
|
Phylum or Division |
Class |
Domestic species
|
Status in ecosystem |
Prior ecotoxicity data |
|
The No. of species |
Potential species |
|
Arthropoda |
Malacostraca |
112 |
Snow bug |
Decomposer |
O |
|
Diplura |
5 |
Campodeid |
Consumer |
O |
|
Insecta |
17,293 |
Scarab |
Consumer |
O |
|
Protura |
24 |
Protura |
Consumer |
- |
|
Diplopoda |
22 |
Millipede |
Consumer |
O |
|
Symphyla |
2 |
Centipede |
Consumer |
O |
|
Mollusca |
Gastropoda |
14 |
Snail |
Consumer |
O |
|
Chlorophyta |
Chlorophyceae |
517 |
Chlorococcum, Chlamydomonas
|
Producer |
O |
|
Trebouxiophyceae |
117 |
Chlorella
|
Producer |
O |
|
Bryophyta |
Andreaeopsida |
2 |
Moss |
Producer |
- |
|
Bryopsida |
566 |
Producer |
O |
|
Polytrichopsida |
25 |
Producer |
- |
|
Sphagnopsida |
20 |
Producer |
O |
|
Tetraphidopsida |
1 |
Producer |
- |
|
Marchantiophyta |
Jungermanniopsida |
281 |
Producer |
O |
|
Marchantiopsida |
26 |
Producer |
O |
|
Euglenophycota |
Euglenophyceae |
236 |
Euglena
|
Producer and consumer |
O |
References
1. H. J.. Klimisch, M.. Andreae, U.. Tillmann, A systematic approach for evaluating the quality of experimental toxicological and ecotoxicological data, Regul. Toxicol. Pharmacol., 25(1), 1-5(1997).  2. S.-H.. Nam, Y.-J.. An, Investigation of Korean native organisms for development of ecotoxicity test: (2) Soil test species, J. Korean Soc. Environ. Eng., 40(1), 48-57(2018).  3. S.-H.. Nam, Y.-J.. An, A rapid screening method to assess soil algal toxicity Non-destructive sampling of algal cells using culture medium extraction, Appl. Soil. Ecol., 120, 143-152(2017).  4. R.. Cui, J. I.. Kwak, Y.-J.. An, Characteristics and toxicity sensitivity of korean dominant species Daphnia galeata for ecotoxicity testing: Comparative study with Daphnia magna, J. Korean Soc. Environ. Eng., 38(4), 193-200(2016).  5. C. W.. Lee, Y. T.. Kwon, J. S.. Yun, S. W.. Moon, Toxicity test of wetland sediments by Simocephalus mixtus, J. Environ. Sci., 11(9), 851-855(2002).
6. J. W.. Lee, J. H.. Kim, S. H.. Park, K. R.. Choi, H. J.. Lee, J. D.. Yoon, M. H.. Jang, Impact of largemouth Bass (Micropterus salmoides) on the population of Korean native fish, crucian Carp (Carassius auratus), Korean J. Environ. Biol., 31(4), 370-375(2013).  7. H. K.. Byeon, Fluctuation of introduced fish and characteristics of the fish community in lake Soyang, Korean J. Environ. Ecol., 29(3), 401-409(2015).  8. C. W.. Lee, Culture method of Simocephalus mixtus (S. mixtus) to evaluate environment toxicity and measurement method of environment toxicity by S. mixtus, (2003).
9. J.. Filser, R.. Wittmann, A.. Lang, Response types in Collembola towards copper in the microenvironment, Environ. Pollut., 107(1), 71-78(2000).  10. J. I.. Kwak, Y.-J.. An, Trophic transfer of silver nanoparticles from earthworms disrupts the locomotion of springtails (Collembola), J. Hazard. Mat., 315, 110-116(2016).  11. S.-H.. Nam, Y.-J.. An, An efficient and reproducible method for improving growth of a soil alga (Chlorococcum infusionum) for toxicity assays, J. Microbiol. Methods., 119, 59-65(2015).  12. National Institute of Biological Resources (NIBR), National list of species of Korea, 2017, (2018).
16. Organization for Economic Cooperation and Development (OECD), TG No. 207. Earthworm, Acute Toxicity Tests, (1984).
17. Organization for Economic Cooperation and Development (OECD), TG No. 208. Terrestrial Plant Test Seedling Emergence and Seedling Growth Test, (2006).
18. Organization for Economic Cooperation and Development (OECD), TG No. 220. Enchytraeid Reproduction Test, (2016).
19. Organization for Economic Cooperation and Development (OECD), TG No. 222. Earthworm Reproduction Test (Eisenia fetida/Eisenia andrei), (2016).
20. Organization for Economic Cooperation and Development (OECD), TG No. 226. Predatory mite (Hypoaspis (Geolaelaps) aculeifer) reproduction test in soil, (2016).
21. Organization for Economic Cooperation and Development (OECD), TG No. 227. Terrestrial Plant Test Vegetative Vigour Test, (2006).
22. Organization for Economic Cooperation and Development (OECD), TG No. 232. Collembolan Reproduction Test in Soil, (2016).
23. American Society for Testing and Materials (ASTM), E1676-12 Standard Guide for Conducting Laboratory Soil Toxicity or Bioaccumulation Tests with the Lumbricid Earthworm Eisenia Fetida and the Enchytraeid Potworm Enchytraeus albidus, (2012).
24. American Society for Testing and Materials (ASTM), E1963-09 Standard Guide for Conducting Terrestrial Plant Toxicity Tests, (2009).
25. American Society for Testing and Materials (ASTM), E2172-01 Standard Guide for Conducting Laboratory Soil Toxicity Tests with the Nematode Caenorhabditis elegans, (2001).
26. International Organization for Standardization (ISO), ISO 10832 Soil quality -- Effects of pollutants on mycorrhizal fungi -- Spore germination test, (2009).
27. International Organization for Standardization (ISO), ISO ISO 11267 Soil quality -- Inhibition of reproduction of Collembola (Folsomia candida) by soil contaminants, (2014).
28. International Organization for Standardization (ISO), ISO 11268-1 Soil quality -- Effects of pollutants on earthworms -- Part 1: Determination of acute toxicity to Eisenia fetida/Eisenia andrei, (2012).
29. International Organization for Standardization (ISO), ISO ISO 11268-2 Soil quality -- Effects of pollutants on earthworms -- Part 2: Determination of effects on reproduction of Eisenia fetida/Eisenia andrei, (2012).
30. International Organization for Standardization (ISO), ISO ISO 11269-1 Soil quality -- Determination of the effects of pollutants on soil flora -- Part 1: Method for the measurement of inhibition of root growth, (2012).
31. International Organization for Standardization (ISO), ISO ISO 11269-2 Soil quality -- Determination of the effects of pollutants on soil flora -- Part 2: Effects of contaminated soil on the emergence and early growth of higher plants, (2012).
32. International Organization for Standardization (ISO), ISO 15952 Soil quality -- Effects of pollutants on juvenile land snails (Helicidae) -- Determination of the effects on growth by soil contamination, (2006).
33. International Organization for Standardization (ISO), ISO 16387 Soil quality -- Effects of contaminants on Enchytraeidae (Enchytraeus sp.) -- Determination of effects on reproduction, (2014).
34. International Organization for Standardization (ISO), ISO 17126 Soil quality -- Determination of the effects of pollutants on soil flora -- Screening test for emergence of lettuce seedlings (Lactuca sativa L.), (2005).
35. International Organization for Standardization (ISO), ISO 17512-1 Soil quality -- Avoidance test for determining the quality of soils and effects of chemicals on behaviour -- Part 1: Test with earthworms (Eisenia fetida and Eisenia andrei), (2008).
36. International Organization for Standardization (ISO), ISO 17512-2 Soil quality -- Avoidance test for determining the quality of soils and effects of chemicals on behaviour -- Part 2: Test with collembolans (Folsomia candida), (2011).
37. International Organization for Standardization (ISO), ISO 18763 Soil quality -- Determination of the toxic effects of pollutants on germination and early growth of higher plants, (2016).
38. International Organization for Standardization (ISO), ISO 20963 Soil quality -- Effects of pollutants on insect larvae (Oxythyrea funesta) -- Determination of acute toxicity, (2005).
39. International Organization for Standardization (ISO), ISO 22030 Soil quality -- Biological methods -- Chronic toxicity in higher plants, (2005).
40. United States Environmental Protection Agency (USEPA), OCSPP 850.3100 Earthworm Subchronic Toxicity Test, (2012).
41. United States Environmental Protection Agency (USEPA), OCSPP 850.4100 Seedling Emergence and Seedling Growth, (2012).
United States Environmental Protection Agency (USEPA), OCSPP 850.4150 Vegetative Vigor, (2012).
43. United States Environmental Protection Agency (USEPA), OCSPP 850.4230 Early Seedling Growth Toxicity Test, (2012).
44. National Institute of Environmental Research (NIER), Study on the development of field application methods in ecological impact assessment on environmental pollutants using bioindicator organisms, (2009).
45. T. H.. Kim, Y.. Hong, N. J.. Choi, Selection of earthworm for bioindicators in agroecosystem, Korean J. Environ. Biol., 27(1), 40-47(2009).
46. M.. Descamps, M. C.. Fabre, C.. Grelle, S.. Gerard, Cadmium and lead kinetics during experimental contamination and decontamination of the centipede Lithobius forficatus L, Arch. Environ. Contam. Toxicol., 31(3), 350-353(1996).  47. F.. Vandenbulcke, C.. Grelle, M.-C.. Fabre, M.. Descamps, Implication of the midgut of the centipede Lithobius forficatus in the heavy metal detoxification process, Ecotoxicol. Environ. Saf., 41(3), 258-268(1998).  48. P.. Kramarz, Dynamics of accumulation and decontamination of cadmium and zinc in carnivorous invertebrates. 2. The Centipede Lithobius mutabilis Koch, Bull. Environ. Contam. Toxicol., 63(4), 538-545(1999).  49. Ł.. Chajec, M. M.. Rost-Roszkowska, J.. Vilimova, A.. Sosinka, Ultrastructure and regeneration of midgut epithelial cells in Lithobius forficatus (Chilopoda, Lithobiidae), Inverte. Biol., 131(2), 119-132(2012).  50. D.. Drobne, Terrestrial isopods- a good choice for toxicity testing of pollutions in the terrestrial environment, Environ. Toxicol. Chem., 16(6), 1159-1164(1997).
51. H.-Y.. Whang, S.-D.. Lee, Studies on effect of CO2 concentration in air and Pb concentration in soil on pillbug growth and bio-accumulation, Environ. Effect. Assess., 19(6), 539-546(2010).
52. S.-D.. Lee, Ecological study on effects of heavy metal accumulation on pillbugs, Environ. Effect. Assess., 20(5), 675-684(2011).
53. M. S.. Achouri, Breeding phenology and reproductive strategies in terrestrial isopod species (Crustacea Isopoda Oniscidea) from Tunisia, Phenol. Climate. Change., 21-34(2012).
54. J. P.. Odendaal, A. J.. Reinecke, Effect of metal mixtures (Cd and Zn) on body weight in terrestrial isopods, Arch. Environ. Contam. Toxicol., 46(3), 377-384(2004).  55. S.. Loureiro, A.. Sampaio, A.. Brandão, A. J. A.. Nogueira, A. M. V. M.. Soares, Feeding behaviour of the terrestrial isopod Porcellionides pruinosus Brandt, 1833 (Crustacea, Isopoda) in response to changes in food quality and contamination, Sci. Total Environ., 369(1-3), 119-128(2006).  56. V.. Mazzeia, G.. Longoa, M. V.. Brundoa, F.. Sinatrab, C.. Copatb, Bioaccumulation of cadmium and lead and its effects on hepatopancreas morphology in three terrestrial isopod crustacean species, Ecotox. Environ. Saf., 110, 269-279(2014).  57. G.. Pigino, M.. Migliorini, E.. Paccagnini, F.. Bernini, C.. Leonzio, Fine structure of the midgut and Malpighian papillae in Campodea (Monocampa) quilisi Silvestri, 1932 (Hexapoda, Diplura) with special reference to the metal composition and physiological significance of midgut intracellular electron-dense granules, Tissue. Cell., 37(3), 223-232(2005).  58. K.. Lock, T.. Adriaens, M.. Stevens, Distribution and ecology of the Belgian Campodea species (Diplura; Campodeidae), Europ. J. Soil. Biol., 46(1), 62-65(2010).  59. G. O.. Graening, Y.. Shcherbanyuk, M.. Arghandiwal, Annotated checklist of the Diplura (Hexapoda: Entognatha) of California, Zootaxa., 3780, 297-322(2014).  60. H.. Hempel, A.. Scheffczyk, H.-J.. Schallnass, J.-P.. Lumaret, Toxicity of four veterinary parasiticides on larvae of the dung beetle Aphodius constans in the laboratory, Environ. Toxicol. Chem., 25(12), 3155-3163(2006).  61. L. C.. Pérez-Cogollo, R. I.. Rodríguez-Vivas, H.. Delfín-González, E.. Reyes-Novelo, M. M.. Ojeda-Chi, Lethal and sublethal effects of ivermectin on Onthophagus landolti (Coleoptera: Scarabaeidae), Environ. Entomol., 44(6), 1634-1640(2015).  62. L. C.. Pérez-Cogollo, R. I.. Rodríguez-Vivas, E.. Reyes-Novelo, H.. Delfín-González, D.. Muñoz-Rodríguez, Survival and reproduction of Onthophagus landolti (Coleoptera: Scarabaeidae) exposed to ivermectin residues in cattle dung, Bull. Entomol. Res., 107(1), 118-125(2017).  63. E.. Nichols, S.. Spector, J.. Louzada, T.. Larsen, S.. Amezquita, M. E.. Favila, Ecological functions and ecosystem services provided by Scarabaeinae dung beetles, Biol. Conser., 141(6), 1461-1474(2008).  64. Y.. Bu, M.. Potapov, W. Y.. Yin, Systematic and biogeographical study of Protura (Hexapoda) in Russian Far East: new data on high endemism of the group, ZooKeys., 424, 19-57(2014).  65. N.. Kaneko, Y.. Minamiya, O.. Nakamura, M.. Saito, M.. Hashimoto, Species assemblage and biogeography of Japanese Protura (Hexapoda) in forest soils, Diversity., 4(3), 318-333(2012).  66. W. H.. Paik, About order protura, Korean J. Pl. Prot., 18(4), 189-198(1979).
67. A. C.. Buch, C. L. S.. Sisinno, M. E. F.. Correia, E. V.. Silva-Filho, Food preference and ecotoxicological tests with millipedes in litter contaminated with mercury, Sci. Tot. Environ., 633, 1173-1182(2018).  68. L. R.. Nogarol, C. S.. Fontanetti, Acute and subchronic exposure of diplopods to substrate containing sewage mud: Tissular responses if the midgut, Micron., 41(3), 239-246(2010).  69. J. A. P.. De Godoy, C. S.. Fontanetti, Diplopods as bioindicators of soils: Analysis of midgut of individuals maintained in substract containing sewage sludge, Water. Air. Soil. Pollut., 210(1), 389-398(2010).  70. T.. Da Silva Souza, C. S.. Fontanetti, Morphological biomarkers in the Rhinocricus padbergi midgut exposed to contaminated soil, Ecotoxicol. Environ. Saf., 741(1), 10-18(2011).  71. S. V.. Joseph, Effects of direct and indirect exposure of insecticides to garden symphylan (Symphyla: Scutigerellidae) in laboratory bioassays, J. Economic. Entomol., 108(6), 2729-2736(2015).  72. U.. Scheller, J.. Adis, A pictorial key for the symphylan families and genera of the neotropical region South of Central Mexico (Myriapoda, Symphyla), Studies. Neotropic. Fauna. Environ., 31(1), 57-61(1996).  73. J. R.. Umble, J. R.. Fisher, Influence of below-ground feeding by garden symphylans (Cephalostigmata: Scutigerellidae) on plant health, Environ. Entomol., 32(5), 1251-1261(2003).  74. T.. Hirano, Y.. Kameda, K.. Kimura, S.. Chiba, Divergence in the shell morphology of the land snail genus Aegista (Pulmonata: Bradybaenidae) under phylogenetic constraints, Biol. J. Lin. Soc., 114(1), 229-241(2015).  75. P.. Ferreira, G. L. G.. Soares, S.. D'ávila, E. C.. Bessa, The influence of thymol + DMSO on survival, growth and reproduction of Bradybaena similaris (Mollusca: Bradybaenidae), Zoologia., 28(2), 145-150(2011).  76. E. H.. Eshra, Toxicity of methomyl, copper hydroxide and urea fertilizer on some land snails, Annal. Agr. Sci., 59(2), 281-284(2014).  77. D.. Angeletti, C.. Sebbio, C.. Carere, R.. Cimmaruta, G.. Nascetti, G.. Pepe, P.. Mosesso, Terrestrial gastropods (Helix spp) as sentinels of primary DNA damage for biomonitoring purposes A validation study, Environ. Molecul. Mutagen., 54(3), 204-212(2013).  78. X.. Wang, W.. Wang, W.. Wang, Z.. Liu, Z.. Yan, C.. Zhang, L.. Chen, Assessment of toxic effects of triclosan on the terrestrial snail (Achatina fulica), Chemosphere., 108, 225-230(2014).  79. L.. Hodač, Green algae in soil: Assessing their biodiversity and biogeography with molecular-phylogenetic methods based on cultures, Doctoral thesis. Georg-August-Universität Göttingen, (2015).
80. B.. Metting, The systematics and ecology of soil algae, The Botanical review., 47(2), 195-312(1981).  81. P.. Sze, A Biology of the Algae, 2nd ed., C.. William(Ed.), Brown Publishers, Dubuque, lowa(2003).
82. G. S. R.. Krishnamurti, S. R.. Subashchandrabose, M.. Megharaj, R.. Naidu, Assessment of bioavailability of heavy metal pollutants using soil isolates of Chlorella sp. Environ. Sci. Pollut. Res., 22(12), 8826-8832(2015).  83. J. M.. Glime, Bryophyta - Andreaeopsida, Andreaeobryopsida, Polytrichopsida, Bryophyte Ecology., 2-6-1. (2017).
84. Y.-E.. Chen, J.-M.. Cui, J.-C.. Yang, Z.-W.. Zhang, M.. Yuan, C.. Song, H.. Yang, H.-M.. Liu, C.-Q.. Wang, H.-Y.. Zhang, X.-Y.. Zeng, S.. Yuan, Biomonitoring heavy metal contaminations by moss visible parameters, J. Hazard. Mat. 296, 201-209(2015).  85. S.-Q.. Sun, G.-X.. Wang, M.. He, T.. Cao, Effects of Pb and Ni stress on oxidative stress parameters in three moss species, Ecotox. Environ. Safe., 74(6), 1630-1635(2011).  86. Y.. Wu, Y.. Chen, Y.. Yi, Z.. Shen, Responses to copper by the moss Plagiomnium cuspidatum: Hydrogen peroxide accumulation and the antioxidant defense system, Chemosphere., 74(9), 1260-1265(2009).  87. X.. Yin, L.. Wang, Y.. Liu, T.. Jiang, J.. Gao, Characterization of arsenic biotransformation by a typical bryophyte Physcomitrella patens, Bull. Environ. Contam. Toxicol., 98(2), 251-256(2017).  88. P. L.. Uniyal, Studies on the West Himalayan Polytrichaceae (Musci), Cytologia., 69(2), 221-224(2004).  89. J.. Hyvönen, S.. Koskinen, G. L. S.. Merrill, T. A.. Hedderson, S.. Stenroos, Phylogeny of the Polytrichales (Bryophyta) based on simultaneous analysis of molecular and morphological data, Molecul. Phylogen. Evolut., 31(3), 915-928(2004).  90. N. E.. Bell, J.. Hyvönen, Phylogeny of the moss class Polytrichopsida (bryophyta): Generic-level structure and incongruent gene trees, Molecul. Phylogen. Evolut., 55(2), 381-398(2010).  91. A.. Breeuwer, M. M. P. D.. Heijmans, B. J. M.. Robroek, F.. Berendse, The effect of temperature on growth and competition between Sphagnum species, Oecologia., 156(1), 155-167(2008).  92. E.. Laine, A.M, Juurola, T.. Hájek, E.-S.. Tuittila, Sphagnum growth and ecophysiology during mire succession, Oecologia., 167(4), 1115-1125(2011).  93. S.. Glatzel, L.. Rochefort, Growing Sphagnum: Foreword, Mire. Peat., 20, 1-3(2017).
94. A.. Saxena, A.. Saxena, Bioaccumulation and glutathionemediated detoxification of copper and cadmium in Sphagnum squarrosum Crome Samml, Environ. Monitor. Assess., 184(7), 4097-4103(2012).  95. A.. Saxena, D. K.. Saxena, H. S.. Srivastava, The influence of glutathione on physiological effects of lead and its accumulation in moss Sphagnum squarrosum, Water. Air. Soil. Pollut., 143(1-4), 351-361(2003).  96. A.. Ghahreman, M.. Farid, S.. Shirzadian, F.. Attar, New and interesting moss records for Iran, Turkish. J. Botany., 31(1), 41-48(2007).
97. H.-P.. Kreier, K.. Feldberg, F.. Mahr, A.. Bombosch, A. R.. Schmidt, R.-L.. Zhu, M.. Konrat, B.. Shaw, A. J.. Shaw, J.. Heinrichs, Phylogeny of the leafy liverwort Ptilidium: Cryptic speciation and shared haplotypes between the Northern and Southern Hemispheres, Molecul. Phylogen. Evolut., 57(3), 1260-1267(2010).  98. S. S.. Choi, V. A.. Bakalin, C.-H.. Kim, B.-Y.. Sun, Unrecorded liverwort species from Korean flora, Korean. J. PI. Taxon., 42, 80-90(2012).  99. K.. Shakya, M. K.. Chettri, T.. Sawidis, Impact of heavy metals (copper, zinc, and lead) on the chlorophyll content of some mosses, Arch. Environ. Contam. Toxicol., 54(3), 412-421(2008).  100. D. C.. Cargill, W. C.. Neal, I.. Sharma, C.. Gueidan, A preliminary molecular phylogeny of the genus Riccia L. (Ricciaceae) in Australia, Australian System Botany., 29, 197-217(2016).  101. K.. Chojnack, Biosorption and bioaccumulation of microelements by Riccia fluitans in single and multi-metal system, Bioresource. Technol., 98(15), 2919-2925(2007).  102. V.. Carginale, S.. Sorbo, C.. Capasso, F.. Trinchella, G.. Cafiero, A.. Basile, Accumulation, localization, and toxic effects of cadmium in the liverwort Lunularia cruciata, Protoplasma., 223, 53-61(2004).  103. S.. O, S. C.. Koh, Chl a fluorescence characterization and biomarker selection from Ricciocarpos natans under cadmium stress, Korean J. Environ. Sci. Int., 22(11), 1403-1413(2013).  104. M.. Einicker-Lamasa, G. A.. Meziana, T. B.. Fernandesa, F. L. S.. Silvaa, F.. Guerrac, K.. Mirandac, M.. Attiasc, M. M.. Oliveiraa, Euglena gracilis as a model for the study of Cu2+ and Zn2+ toxicity and accumulation in eukaryotic cells, Environ. Pollut., 120(3), 779-786(2002).  105. M.. Watanabe, K.. Henmi, K.. Ogawa, T.. Suzuki, Cadmium-dependent generation of reactive oxygen species and mitochondrial DNA breaks in photosynthetic and nonphotosynthetic strains of Euglena gracilis, Com. Biochem. Physiol. Part C., 134(2), 227-234(2003).
106. S.. Kottuparambil, Y.-J.. Kim, H.. Choi, M.-S.. Kim, A.. Park, J.. Park, W.. Shin, T.. Han, A rapid phenol toxicity test based on photosynthesis and movement of the freshwater flagellate, Euglena agilis Carter, Aquat. Toxicol., 155, 9-14(2014).  107. A.. Azizullah, P.. Richter, D.-P.. Häder, Comparative toxicity of the pesticides carbofuran and malathion to the freshwater flagellate Euglena gracilis, Ecotoxicolgy., 20(6), 1442-1454(2011).  108. J. D.. García-García, K. A.. Peña-Sanabria, R.. Sánchez-Thomas, R.. Moreno-Sánchez, Nickel accumulation by the green algae-like Euglena gracilis, J. Hazard. Mat., 343, 10-18(2018).  109. J. D.. García-García, J. S.. Rodríguez-Zavala, R.. Jasso-Chávez, D.. Mendoza-Cozatl, R.. Moreno-Sánchez, Chromium uptake, retention and reduction in photosynthetic Euglena gracilis, Arch. Microbiol., 191(5), 431-440(2009).  110. J. L.. Jakalski, M. A. Q.. Khan, Photolysis of aldrin and dieldrin in a phytoplankton, Arch. Environ. Contam. Toxicol., 24(1), 75-77(1993).  111. J. P.. Barque, A.. Abahamid, Y.. Bourezgui, H.. Chacun, J.. Bonaly, Growth responses of achlorophyllous Euglena gracilis to selected concentrations of cadmium and pentachlorophenol, Arch. Environ. Contam. Toxicol., 28(1), 8-12(1995).  112. L.. Navarro, M. E.. Torres-Márquez, S.. González-Moreno, S.. Devars, R.. Hernández, R.. Moreno-Sánchez, Comparison of physiological changes in Euglena gracilis during exposure to heavy metals of heterophic and autotrophic cells, Comp. Biochem. and Physiol. Part C: Pharmacol. Toxicol. Endocrinol., 116(3), 265-272(1997).
113. I.. Rocchetta, H.. Küpper, Chromium- and copper-induced inhibition of photosynthesis in Euglena gracilis analysed on the single-cell by fluorescence kinetic microscopy, New Phytologist., 182(2), 405-420(2009). 
|
|











