The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
순환식 수경재배를 위한 수처리 기술
Abstract
Hydroponics is a cultivation technology of growing plants in nutrient solutions without soil. Hydroponic cultivation has the advantages of high yield per unit area and high quality crop production, however, there is a problem that the waste hydroponic nutrient solution can cause eutrophication when discharged into aquatic systems. In hydroponic cultivation, generally 30% of the nutrient solution is drained. By introducing closed hydroponic water treatment system, it is possible to prevent environmental pollution and reduce the cost of fertilizer and water resources. To reuse the nutrient solution, the plant pathogenic bacteria must be sterilized, while the nutrients contained in the waste hydroponic solution must be preserved. In the Netherlands and Europe, where hydroponic cultivation is developed, the distribution rate of the closed hydroponic system is more than 95%, but is less than 5% in Korea. In order to prepare for environmental regulations related to discharge of hydroponic solutions and to increase the distribution rate of closed the hydroponic system in Korea, it is necessary to develop Korean-type nutrient solution treatment technology. This review provides the characteristics and examples of the physical and chemical water treatment processes for closed hydroponic system so far and analyzed the current technology status of commercial closed hydroponic water treatment system. In addition, we suggest the development direction of closed hydroponic water treatment technology suitable for korean hydroponic characteristics.
Key words: Closed Hydroponic Cultivation System, Hydroponic Solution, Water Treatment, Plant Pathogen, Sterilization
요약
수경재배는 토양을 이용하지 않고 액상비료인 양액으로 작물을 재배하는 방법이다. 수경재배는 단위 면적당 높은 생산량, 고품질 작물생산의 장점이 있으나 사용한 폐양액이 수계로 방류되면 부영양화를 일으킬 수 있는 문제가 있다. 수경재배 시 일반적으로 급액된 양액의 30%가 배액되는데, 이를 재이용하는 순환식 수경재배를 도입하면 환경오염을 방지하고, 비료 및 수자원 비용을 절감 할 수 있다. 양액을 재이용하기 위해서는 폐양액에 포함된 영양소는 유지하되, 식물 병원균은 살균하는 수처리 기술이 필요하다. 수경재배가 발달한 네덜란드 및 유럽은 순환식 수경재배 시스템 보급율이 95% 이상이지만, 국내에는 5% 미만으로 낮다. 국내 순환식 수경재배 관련 향후 환경규제를 대비하고, 순환식 양액재배 시스템 보급율을 높이기 위해서는 한국형 순환식 양액재배 수처리 기술개발이 필요하다. 본 총설에서는 순환식 수경재배에 대표적으로 사용된 물리/화학적 수처리 공정의 특징과 사례를 소개하고, 국내외 순환식 수경재배 시스템 현황에 대해 분석하였다. 더불어 국내 수경재배 특성에 적합한 순환식 수경재배 수처리 기술개발 방향에 대해 논의해 보고자 한다.
주제어: 순환식 수경재배, 양액, 수처리, 식물 병원균, 살균
1. 서 론
수경재배(hydroponics)는 토양을 이용하지 않고 작물을 여러 방법으로 고정 후 생육에 필요한 원소가 포함된 액상비료(양액)로 작물을 재배하는 방법이다. 따라서 수경재배는 양액재배, 무토양재배로도 불린다. 전통적으로 사용된 토양재배는 시설비용이 저렴한 장점이 있으나, 식물의 생장에 필요한 양보다 많은 비료를 사용하고, 연작 장해 등의 단점이 있다[ 1]. 수경재배는 비료 및 생육환경을 효율적으로 관리할 수 있어서 단위 면적당 생산량이 높고 고품질의 과채류 생산이 가능하며, 토양의 연작 장해와 같은 염려가 없다[ 2]. 이러한 수경재배의 장점으로 2000년 700 ha였던 우리나라 수경재배 면적이 2017년 3,355 ha로 재배 면적이 5배 이상 크게 증가하고 있다( Fig. 1) [ 3, 4]. 우리나라의 수경재배 면적은 다른 나라의 수경재배 면적과 비교하면 대략 세계 10위권 이내 수준이다( Table 1) [ 5, 6]. 하지만 호당 면적 규모는 0.46 ha (2012년 기준)로 네덜란드에서 허용하는 온실 최소규모인 4.5 ha에 비해 작은 편이다[ 5]. 우리나라는 2018년 기준으로 수경재배의 92%는 채소작물이 차지하고 있으며, 딸기(1,752 ha), 토마토(753 ha), 파프리카(544 ha)가 주를 이룬다[ 7]. 수경재배는 식물 지지체 배지의 사용유무 및 배지 종류, 배양액의 근권 유동방법 등에 따라서 담액수경(Deep Flow Technique, DFT), 박막수경(Nutrient Film Technique, NFT), 암면재배(Rockwool Culture) 등으로 다양하게 세분화된다[ 8]. 그리고 양액의 처리 방식에 따라 크게 비순환식 수경재배와 순환식 수경재배로 나뉜다. 비순환식 수경재배는 사용한 양액을 재사용하지 않는 방식이며, 순환식 수경재배는 사용한 양액을 정화하여 재사용하는 방식이다. 비순환식의 경우 사용된 폐양액이 주변 환경으로 배출되어 녹조 현상, 지하수오염 등의 환경문제를 일으키는 원인이 된다[ 9, 10]. 네덜란드는 환경오염을 막기 위해 1994년 순환식 수경재배로 전환을 법제화(The Waste Water Disposal Decree)하여 현재 순환식 수경재배 보급율이 95% 이상이며, 일본에도 순환식 수경재배가 45% 이상 도입되어 있다[ 5]. 우리나라는 아직 폐양액 배출 및 처리에 대한 세부 기준이 마련되지 않은 상황이며, 수질환경보전법으로 산업체 폐수로 분류하여 배출허용기준을 총 질소 60 mg/L, 총인 8 mg/L 이하로 규제한다[ 10, 11]. 그리고 친환경농업 육성법을 통해 무농약 및 저농약 농산물 인증을 받기 위한 조건으로 순환식 수경재배를 명시하고 있으나[ 12] 현재까지 국내 순환식 수경재배 시스템의 보급율은 5% 미만으로 낮다[ 7, 13]. 이는 비순환식 수경재배 시스템 대비 순환식 수경재배 시스템의 초기 투자비용이 10~15% 높고 설치 후에도 주기적(2주 간격)으로 재사용 양액 분석 등의 운영비 상승 때문에 순환식 시설 사용을 꺼리기 때문으로 분석된다[ 5]. 순환식 수경재배가 초기투자 비용 측면에서 단점이 있지만, Table 2에 나타낸 바와 같이 비료 및 수자원 비용 측면에서는 비용 절감의 장점이 있다[ 14, 15]. 일반적으로 수경재배에 급액된 양액의 20~30%가 배액된다. 순환식 수경재배 시스템 설치비용을 고려하더라도, 토마토 재배 배액량 30%, 0.3 ha에서 10개월 재배 기준으로 원수 및 비료절감에 따른 이익이 1,130천원으로 추정된다[ 5]. 따라서 환경보전과 양액 재활용으로 비료 비용을 절감하기 위해 경제적 순환식 양액 시스템의 개발 및 보급이 필요하다. 순환식 수경재배를 위해서는 i) 사용된 양액 내의 병원균을 살균하여 재이용 시 병원균 확산을 방지할 수 있는 시스템이 구축되어야 하며, ii) 살균 처리 이후에도 배액의 영양성분을 보존시킬 수 있어야 한다. 그리고 iii) 배액과 보충 원수 및 양액의 혼합비율을 조절하여 영양성분을 지속적으로 유지할 수 있는 시스템이 필요하다[ 9]. 본 논문에서는 폐양액 재이용 시 고려해야할 요소인 양액 내 영양분과 식물 병원균을 살펴보고, 순환식 수경재배를 위한 살균 수처리 기술을 중심으로 기술 현황과 향후 순환식 수경재배를 위한 국내 수처리 기술개발 방향에 대해 논의하고자 한다.
2. 양액 및 수경재배 병원균
2.1. 양액 성분 및 수질
수경재배에서 양액은 작물의 생산량과 품질에 영향을 미치는 중요한 요소이다. 작물성장에 필요한 원소는 17가지로서 탄소(C), 수소(H), 산소(O), 질소(N), 인(P), 칼륨(K), 칼슘(Ca), 마그네슘(Mg), 황(S), 철(Fe), 구리(Cu), 아연(Zn), 망간(Mn), 몰리브덴(Mo), 보론(B), 염소(Cl), 니켈(Ni)이 포함된다[ 16]. 대기로부터 공급되는 탄소와 산소를 제외한 나머지 원소들은 양액으로 공급해 주어야 하며, 이중 성장에 가장 중요한 6대 원소는 질소, 인, 칼륨, 칼슘, 마그네슘, 황이다. 6대 원소 공급은 질산염(NO 3-), 인산염(H 2PO 4-), 황산염(SO 42-) 형태의 음이온과 암모늄(NH 4+), 칼륨(K +), 칼슘(Ca 2+), 마그네슘(Mg 2+) 형태의 양이온으로 상호간 비율을 맞추어 공급한다. 양액 제조 시 영양소를 이온 형태로 원소를 물에 녹여 공급하기 때문에 물속의 전하 균형(charge balance)으로 한 가지 이온만을 주입할 수 없고, 전하가 상쇄되는 양이온과 음이온을 동시에 주입하게 됨을 고려해야 한다[ 17]. 공급된 양액 성분은 일부만 작물에 흡수되고, 성분의 대부분이 배출된다. 예를 들어 홍학꽃(안수리움(Anthurium))의 경우 60% 이상의 양액 성분이 흡수되지 않고 배출된다[ 18]. 순환식 양액재배 시 주요 영양성분의 농도가 최소 필요량보다 낮아질 경우에는 과채류의 품질이 저하될 수 있으므로, 추가적인 주입이 필요하다[ 9]. 양액을 제조하는 용수는 지하수, 하천수, 수돗물, 빗물 등이 사용된다. 양액 제조에 사용되는 물의 EC (Electrical Conductivity) 값은 0.3 dS/m (=300 µS/cm) 이하이며, pH는 5~8 범위가 적합하다[ 17]. 용수에 포함된 Table 3에 나타낸 한계농도를 초과하는 성분이 있을 경우 수질 개선이 필요하며, 용수에 포함되어 있는 염류 중 가장 문제가 되는 성분은 나트륨과 염소이다. 또한 과잉 철성분과 중탄산 이온도 문제를 일으키기도 하는데, 과잉 염류를 제거하기 위해서 역삼투, 증류법, 이온교환법, 전기투석법이 사용된다[ 17]. 양액은 일반적으로 2가지의 100배 고농도 용액을 각각 탱크에 준비한 후 양액 용수에 혼합, 희석하여 사용한다. 2가지 농축양액 제조는 상용화된 혼합비료를 사용할 수도 있고, 필요 영양소를 개별 혼합하여 제조 가능하다. 각 영양소는 작물의 종류 및 성장단계별로 농도가 다르게 적용될 수 있다. 양액 조성의 예로서 야마자키 양액 조제법에 따른 토마토용 100배 농축 양액 제조법과 작물별 양액 농도를 Table 4와 Table 5에 나타내었다[ 17, 19]. 양액 용수 조건에 따라 최종 야마자키 양액의 EC 및 pH가 달라질 수 있으나, 일반적으로 EC는 1,200~1,600 µS/cm, pH 5.5~6.5가 적당하다[ 20]. Table 5에 나타낸 야마자키 토마토 양액의 성분별 농도에 따르면 총 질소 98 mg/L, 총 인 61.9 mg/L가 포함되어 있다. 수질환경보전법의 배출허용기준이 총 질소 60 mg/L, 총 인 8 mg/L인 것[ 11]을 감안하면 폐양액은 살균처리 후 재이용하거나, 정화시설을 설치하여 처리 후 방류하여야 한다.
2.2. 식물 병원균
순환식 수경재배에서는 순환하는 배양액에 의해 작물이 병원균에 급속하게 감염될 수 있기 때문에 양액 재이용 시 폐양액 내의 병원성 미생물을 살균, 제거하여야 한다. 그리고 폐양액 처리 시 병원균은 살균하되, 양액의 영양분은 제거하지 않고 유지하는 것이 관건이다. 양액재배에서 대표적으로 발생하는 병원균은 피시움(Pythium) 속이 가장 많으며, 피토프토라(Phytophthora)와 후사리움(Fusarium)속 균 또한 대표적으로 발생하는 병원균이다[ 21]. 피시움과 피토프토라 속 균은 유주자를 형성하는 편모류균에 속하는 병원균이며 후사리움은 사상균에 속한다. 피시움은 토양에 흔히 발견되며 시설 재배지에서도 자주 발생한다. 피토프토라의 경우 피시움에 비해서는 발생빈도가 낮으나 피시움 보다 살균 저항이 강한 특징이 있다[ 21]. 피시움과 피토프토라는 난포자(Oospore)를 형성하여 극한 조건에서도 수년간 생존 가능하며 후사리움의 포자도 생존력이 강하다[ 22]. 피시움의 난포자 크기는 보통 15~19 µm이다( Fig. 2). 이러한 병원균은 양액을 통해서 여러작물로 감염되며 근부병, 위조병, 청고병 등의 피해를 주기 때문에 순환식 수경재배시스템에서 살균 수처리 공정은 필수적이다.
3. 순환식 수경재배를 위한 수처리 기술
순환식 수경재배에 사용된 수처리 기술은 크게 물리적 처리공정(완속 모래여과, 열살균, UV, 막여과 등) 및 화학적 처리공정(산화제를 이용한 약품소독)으로 분류된다. 본 장에서는 순환식 수경재배에 활용되고 있는 주요 수처리 살균 공정들의 특징 및 제거 메커니즘에 대해서 소개한다. Table 6에는 각 살균공정의 장단점 및 대략적인 초기 설치비용을 요약 정리하였으며[ 1, 24], Table 7에는 처리용량에 따른 각 살균 공정의 운영비용을 나타낸다[ 25~ 30]. Table 7의 수경재배 살균공정 규모 분류에 나타나 있듯이, 수경재배 살균공정은 상․하수처리장의 살균공정에 비해 용량이 작은 것이 특징이다. 소규모 시설의 설치비용 및 운영비용은 관련 문헌 자료가 대규모 시설에 비해 부족하며, 국가별로 기자재 비용이 달라 Table 7에 제시된 비용은 국내에 적용 시에는 차이가 있을 수 있다. 대략적인 값으로 참고하는 것이 바람직할 것으로 사료된다.
3.1. 물리적 처리공정
3.1.1. 완속 모래여과
완속 모래여과는 1892년 독일, Hamburg에서 강물의 콜레라로 인한 수인성 전염병에 효과적인 공정임이 입증되어 음용성 수질정화 공정으로 전통적으로 널리 사용되어 왔다[ 31]. 1980년대에 Wohanka가 완속 모래여과 공정이 농업용수 및 비료용액의 재사용 시 식물 병원균을 제거함을 증명한 이후 순환식 양액재배 공정에 널리 사용되었다[ 31]. 모래여과는 크기가 다른 다수의 모래 및 자갈층 그리고 하층부의 배수 배관으로 구성된다. 상층부로 유입된 물은 상부 모래층의 슈뮤츠데케(Schmutzdecke)라는 미생물 층에서 생물학적으로 정화되며, 하부 여재층을 통과하면서 입자가 포집되어 물리적으로 정화된다[ 32]. 완속 모래여과는 병원균 효율이 높은 장점이 있으며 제거 효율은 비료의 성상, pH, EC 값에 크게 영향을 받지 않지만, 용존 산소량에 따라서 모래여과의 미생물 활동에 의한 제거는 영향을 받을 수 있다[ 1]. 정화 유속은 100~300 Lm -2h -1 (10~30 cm/h)이며, 완속여과의 효율은 여재의 종류와 높이에 연관이 있다[ 23]. 여재 높이는 최소 0.8~1.2 m로 충분한 접촉 시간을 갖도록 설계된다. 슈뮤츠데케 미생물층 정화를 위해서는 완속여과 상부층이 항상 물에 잠겨 있는 상태가 유지되어야 한다. 일반적으로 중력에 의해 물이 여과되며, 충분한 유속을 갖기 위해서 80~150 cm의 물이 여재 상부에 채워진다. 모래 여재는 0.15~0.3 mm의 크기가 사용되며, 자갈층은 2~8 mm, 8~16 mm, 16~32 mm의 3종류로 채워져 모래층을 지지한다. 원수의 수질에 따라서 몇 주 혹은 몇 달마다 최상부 층을 제거함으로써 유로가 막히는 것을 방지한다[ 23]. 완속 모래여과에서 Phytophthora, Fusaium, bacteria, nematodes, virus의 제거율이 99~99.99%로 높은 것으로 알려져 있다[ 1]. 하지만 여재의 종류, 온도, 운전기간 등 조건에 따라서 제거효율이 다르며, 완벽하게 살균이 되지 않을 수 있다. 예를 들어 Rockwool 여재는 Xanthomonas campestris pv. pelargonii의 제거율이 99%임에 반해 모래여재는 83%, antracite는 82%의 제거율을 나타내었다[ 33]. 그리고 Tomato mosaic virus의 제거율은 초기 80%에서 6일 후 23%까지 감소됨이 보고되었다[ 1]. 따라서 병원성 미생물을 완벽히 제어하기 위해서는 완속 모래여과와 함께 추가적인 살균 공정을 함께 사용하는 것인 안정성을 높일 수 있을 것으로 판단된다. 완속 모래여과층의 상부 미생물층인 슈뮤츠데케층은 시간에 따라서 두꺼워지고, 여과속도를 줄이기 때문에 주기적인 세정이 필요하다. 세정을 위해서는 상부의 5~8 cm 모래층을 거두어내고 새 모래층으로 교체되며, 24시간 동안 모래층을 잠기게 한 후 완속 모래여과 공정이 재가동된다[ 25]. 완속 모래여과는 29~38 m 3/day 수준의 소규모 시설의 경우 초기 투자비용이 5,300~6,900천원이며, 특히 운영비용이 타 공정에 비해 매우 낮다[ 25].
3.1.2. 열살균
근부병균, 위조병균과 청고병 등 양액으로 전염되는 병원균은 배양액을 50~60℃로 가온하여 30~60분 순환시키면 자재와 장치전체를 살균 가능하다[ 17]. 재배기간 중에는 양액을 가열기로 온도를 상승시킨 후 열교환기로 온도를 낮추어 재배조에 공급한다. Runia 등[ 34]에 따르면, Tomato mosaic virus의 경우 95℃에서 10초간 처리 후 살균되었으며, 순환식 양액재배를 위한 열살균 조건으로 95℃에서 30초를 제안하였다. 그리고 이와 유사하게 토마토와 오이에 대해서 Phytophthora cryptogea와 Phyium aphanidermatum이 95℃에서 30초간 처리 후 살균됨이 보고되었다[ 35]. 열살균을 이용한 순환식 양액재배는 네덜란드와 영국에서 널리 사용되고 있는 방법으로 95℃에서 30초간 처리된다. 종종 양액에 존재하는 큰 입자를 제거하기 위해서 급속 모래여과가 함께 설치된다. 양액 가열시 탄산염이 가열코일이나 파이프에 침전되기 때문에 소량의 산이 첨가되기도 한다[ 1]. 열살균은 살균효과가 높지만 배양액의 온도가 상승 할 수 있기 때문에 온도 모니터링이 중요하다. 또한 온도가 상승하면 용존 산소의 농도를 떨어뜨리기 때문에 이에 대한 영향을 고려할 필요가 있다. 열살균 공정의 장점은 모든 미생물의 살균이 가능하며, 불순물이 많은 폐양액에도 적용가능하고, 화학 물질의 잔류 문제가 없다는 점이다. 단점으로는 높은 설치비용, 설치면적 그리고 운영비용(8.8 kWh/m 3)을 들 수 있다[ 36].
3.1.3. UV살균
자외선(UV)은 10~400 nm의 파장 영역의 빛으로 100~280 nm 파장영역인 UV-C가 가장 강력한 살균력을 갖는다. 가장 살균력이 높은 파장은 265 nm로 알려져 있다. UV는 세균의 DNA에 pyrimidine dimer를 형성시켜 DNA 복제를 방해하여 돌연변이, 악성형질변이, 세포사 등의 장해를 준다[ 37]. UV 소독 강도는 UV조사 강도(mW/cm 2)와 조사시간(sec)의 곱인 UV 조사량(mJ/cm 2)으로 표현된다. 바이러스를 포함한 광범위한 미생물에 효과가 있으며, 특히 Giardia와 Cryptosporidium은 UV에 의한 DNA 손상 효과가 큰 것으로 알려져 있다[ 38]. 필요 UV 조사량은 토마토 근부위조병( Fusarium oxysporum, f. sp.)은 92 mJ/cm 2, 토마토 회색역병균( Phytophthora capsiici)은 100 mJ/cm 2, 토마토 근부병균( Pythium myriotylum) 66 mJ/cm 2, 피사움( Pythium) 속 균은 123~250 mJ/cm 2이다[ 17]. 바이러스는 종류에 따라서 UV 효과가 크게 다르며, 전반적으로 세균포자는 UV에 대한 저항이 크다[ 39]. 병원성 세균 및 진균류를 제어하기 위해서는 100 mJ/cm 2, 바이러스를 포함한 완벽한 살균을 위해서는 250 mJ/cm 2이 제안된다. 상용화된 UV-C 시스템은 UV 램프 내부 증기압력에 따라서 저압(약 0.01 mbar), 중압(1~10 bar)램프로 나누어진다. 저압램프는 254 nm 파장의 자외선을 내기 때문에 에너지 효율이 높다. 중압 램프는 254~265 nm 사이의 넓은 파장을 내기 때문에 에너지 효율측면에서는 불리하지만, 저압 램프에 비해 10배 이상 높은 UV에너지 강도를 조사한다[ 40, 41]. 따라서 설치면적을 줄이고, 유지관리 비용이 낮다. 중압 램프의 경우 일반적으로 1개의 램프로 구성되고, 3,000~4,000 시간의 수명을 가지며 시간당 1.5~10 m 3을 처리 가능하다. 저압 UV램프 설비는 여러 개의 램프로 구성되며, 처리용량은 시간당 0.05~0.3 m 3정도이며, 수명은 6,000~8,000 시간이다. 1개의 저압 UV 램프용량은 50~300 W이다[ 5]. UV는 미생물에 직접 조사해야하기 때문에 뿌리 잔재물에 들어 있는 병원균에는 효과가 없다. 그리고 양액의 투과도가 낮으면 UV 조사선량이 저하되어 충분한 효과를 얻을 수 없기 때문에 전처리 필터를 이용하여 뿌리나 협잡물을 제거할 필요가 있다. 양액성분 중 킬레이트-철이 불용화되는 문제가 발생할 수 있어서 UV 소독 후 철(Fe)에 대한 성분 보정이 필요하다. 일반적으로 UV살균 공정의 초기 시설비용은 모니터링 시스템 및 제어 시스템 규모에 따라 달라지며 22,000~70,000천원 수준으로 높은 편이지만, 운영비용은 타 공정과 비교해서 저렴하다[ 26].
3.1.4. 막여과
막(membrane)은 막공의 크기에 따라서 정밀여과(microfiltration, MF), 한외여과(ultrafiltration, UF), 나노여과(nanofiltration, NF), 역삼투여과(reverse osmosis, RO)로 나뉜다. MF와 UF의 경우 막공 크기가 각각 0.1~10 μm와 10~100 nm이며, NF와 RO는 막공크기가 각각 1~10 nm, 1~0.1 nm이다( Fig. 3) [ 42]. UF, NF 및 RO의 경우 막공 크기가 작기 때문에 제거 가능한 분자량의 크기인 MWCO (Molecular Weight Cut-Off)로 표현되기도 하며, 경험식에 따르면 MWCO와 크기는 dH=0.11*(MW) 0.46의 관계를 갖는다[ 42]. 여기서 dH는 막공 크기(nm), MW는 분자량(g/mol)을 의미한다. 막에서는 주로 막공 크기의 의한 크기배제로 병원균이 제거된다. 그리고 표면 흡착, 막의 표면 전하성 입자성 물질의 전하 반발력으로 제거가 되기도 한다[ 43]. 멤브레인은 곰팡이류[ 44, 45], 박테리아[ 46], 선충[ 47] 병원균을 대상으로 순환식 양액재배 시스템 및 관개용수 처리에 적용하여 왔다. MF는 protozoan parasites와 박테리아를 효과적으로 제거하며 일부 바이러스의 제거가 가능하다. 일반적으로 Pythium myriotylum의 정포자(zoospore cysts) 크기는 8~10 µm이다. Shuerger [ 31] 등이 수행한 피망재배 양액재순환 시스템에서 Pythium myriotylum 제거 연구에 따르면, Pythium myriotylum의 정포자 제거율은 MF막 브랜드에 따라서 차이가 있지만 1~30 μm의 막공 크기를 갖는 MF막은 85~95%의 제거 성능을 나타내었다. 하지만 여과 가압조건에서 병원균 세포의 형태 변형, 크기 감소로 MF 막공크기보다 작은 병원균이 막을 통과할 수 있는 것으로 확인되었다[ 39]. 따라서 실제 양액재순환 시스템에 막여과 기술을 적용 시에는 제거하고자 하는 병원성 미생물보다 크기가 작은 막공의 멤브레인을 선정하고, 사전 제거 테스트를 실시하는 것이 안전하다고 판단된다. 또한 단일 멤브레인 처리 공정보다는 2단 이상의 멤브레인 여과를 거치면 안정성을 높일 수 있다. Goldberg [ 44] 등에 따르면 20 µm와 7 µm 멤브레인을 순차적으로 통과시킨 폐양액에서 오이 근부병을 일으키는 Pythium을 효과적으로 제거 가능하였다. 병원성 바이러스는 15~300 nm의 크기를 갖기 때문에 MF로는 완벽한 제거가 어렵다. 하지만 UF의 경우 작은 막공 크기를 가지고 있어 바이러스의 제거율이 높다. Liu [ 48] 등의 결과에 따르면 MWCO 30K Da UF막은 Tomato Mosaic Virus를 99% 제거 가능하였으며, 5K Da UF막은 100% 제거 가능하였다. 또한 주요 양액성분은 UF막을 통과하여 재사용이 가능한 것으로 보고되었다. NF와 RO는 막공 크기가 각각 1~5 nm, 1~0.1 nm로 작기 때문에 실질적으로 모든 병원균을 제거할 수 있다. 하지만 NF와 RO는 병원균뿐만 아니라 양액에 포함된 영양분도 함께 제거되기 때문에 폐양액 처리 후 작물에 재사용하기에는 적합하지 않다[ 14]. 막여과 공정에서의 가장 큰 문제는 사용기간 중의 막오염 현상이다. pH 6.7 이상에서는 양액에 포함된 염이 침전하여 막공을 막을 수 있기 때문에 양액의 pH 관리가 중요하다. pH를 4.5, 5.5, 6.5에서 MF를 활용한 양액처리 실험에 따르면 pH 5.5 이하에서 막여과 시스템의 운전이 4주 이상에서도 안정적이었다[ 31]. 또한 막여과 공정에서는 역세 및 화학세정을 실시하여 막오염을 최소화하고 유지 관리하는 것이 중요하다. 막여과 공정의 초기 시설비용은 규모에 따라서 달라지며, 대략적으로 UF 및 MF의 경우 필요 막면적 m 2 당 530~2,000천원으로 타공정과 비교해서는 고가이다[ 49]. 운영비용은 처리 유량 m 3 당 0.2천원 수준으로, 규모별로 운영비용은 Table 7과 같이 예측된다[ 30].
3.2. 화학적 처리공정
염소, 오존, 과산화수소 등의 약품 소독제는 병원균의 세포를 산화시켜 살균을 한다. 약품 소독제에 따라서 산화강도, 산화시키는 세포의 부위, 약품의 지속력이 다르다. 또한 미생물에 따라서 약품 소독에 대한 내성이 달라지는데, 그램 음성균 < 그램 양성균 < 바이러스 < 세균포자 < 병원성 원생동물 순으로 약품 소독에 대한 내성이 강해진다[ 39]. 약품 소독은 농도(C)와 처리시간(T)의 곱인 CT값으로 효과가 결정된다. 즉, 필요 농도와 접촉시간은 서로 trade-off 관계를 갖고, 고농도는 짧은 접촉시간이 필요하며, 낮은 농도에서는 긴 접촉시간이 필요하다.
3.2.1. 염소
염소는 가스형태인 염소가스, 액체형태인 차아염소산 나트륨(NaOCl), 차아염소산(HOCl), 고체형태인 차아염소산 칼슘(Ca(ClO 2))이 주로 사용된다[ 22]. 산화력을 갖는 주요한 염소형태는 강한 산화력을 갖는 HOCl(차아염소산)과 약한 산화력을 갖는 OCl-(차아염소산 이온)이 있으며 pH에 따라 두 물질의 비율이 달라진다. pH 7.5 이하에서는 강한 산화력을 가지는 HOCl의 분포가 높아지므로 이를 고려한 용액이 pH조절이 필요하다. 염소는 병원균의 세포막을 산화시키며 염화이온(Cl -)으로 환원된다. 일반적으로 관개용수 소독을 위해서 2 mg/L의 염소가 사용된다. 하지만 mycelia와 oomycetes sporangia는 4 mg/L의 염소농도에서 각각 0.5분, 8분의 접촉시간이 필요하며, Furasium oxysporum은 8 mg/L에서 5분 접촉시간이 필요하다[ 51]. 순환식 온실재배 관개용수의 경우 4 mg/L가 사용되며 오이잎 바이러스(Cucumber leaf virus)를 살균하기 위해서는 30분의 접촉시간이 필요하다[ 52]. 작물의 종류에 따라서는 식물 병원균을 살균하는데 필요한 농도보다 낮은 농도에서 식물 독성이 보고되었다. 예를 들어, 2.4 mg/L의 유리염소(free chlorine) 농도에서도 낙엽 관목의 잎 생장에 영향을 미치는 것으로 나타났다[ 23]. 염소로 인한 식물독성 영향을 줄이기 위해 낮은 농도와 긴 접촉시간, baffle 시스템, 염소 소독 후 활성탄 칼럼을 통과시키는 방법이 사용되기도 한다[ 52]. 염소 가스는 가격이 저렴하지만 운영하기 위한 시설비용이 차아염소산 나트륨보다 높다. 또한 염소 가스형태로 사용 시에는 누출방지를 위한 안전시설 설치도 고려하여야 한다. 따라서 소규모 시설에서는 염소 가스형태보다는 차아염소산을 사용하는 것이 바람직하다[ 39].
3.2.2. 오존
오존의 살균은 직접적으로 병원균을 산화시키거나 수산화 라디칼이나 초과산화 이온(superoxide ion)을 생성시켜 살균한다. 오존은 불안정한 가스로서 현장에서 코로나 방전(corona discharge) UV 조사(UV radiation)를 통해서 생성시킨다[ 53]. 일반적으로 1 mg/L 이하의 농도가 온실 관개에 적용된다[ 54]. 문헌에 따르면 박테리아(bacteria), 균류(fungi), 난균류(oomycetes)의 살균을 위해서는 최소 오존 농도가 각각 0.5 mg/L, 0.7 mg/L, 0.8 mg/L, 7.9 mg/L 필요하며 이때의 접촉시간은 1분, 16분, 8분, 75분이 필요하다[ 22]. 오존 또한 다른 약품 소독제처럼 고농도로 작물에 적용되면 식물 독성을 유발한다. 화목(woody ornamentals)을 6주 동안 양액 방사체에서의 오존 농도가 0.9 mg/L 이상에서 재배했을 때 식물 독성이 있는 것으로 나타났으며, 오존은 잎의 크기, 묘조 및 뿌리의 크기에 영향을 미칠 수 있다[ 55]. 오존은 양액에 포함된 철과 망간이 산화시켜 침전물을 발생시킬 수 있으며 추가적인 보충이 필요할 수 있다[ 22]. 오존은 물속에서 반응속도가 크기 때문에 농도를 측정하기가 쉽지 않다. UV 흡광도를 이용하여 오존 농도를 측정하기도 하는데, 이러한 오존 농도 측정시스템 비용은 대략 6,000~8,800천원 소요된다[ 28]. 따라서 오존 살균 공정은 초기 설치비용이 높기 때문에( Table 6) 소규모 시설보다는 대규모 시설에서 경제성을 갖는다.
3.2.3. 과산화수소
과산화수소는 산화력이 강하며 환원 부산물로 물과 산소가 생성되는 장점이 있다. 과산화수소는 34 mg/L 농도에서 Fusarium 생장을 억제하는데 효과가 있으며[ 56], 100 mg/L에서 5분간 접촉 시 Fusarium을 완벽히 사멸시킨다[ 34]. 과산화수소는 조류의 생성을 막기 위해서도 사용되며, 오존 혹은 UV와 함께 사용할 경우 수산화 라디칼이 생성되어 산화력을 높일 수 있다. 조류를 방지하기 위해 50 mg/L 이상 사용 시 식물독성을 일으킬 수 있는 것으로 보고되었다[ 57]. 식물에 미치는 독성은 작물에 따라서 다른데, 상추의 경우 8 mg/L, 오이에서는 125 mg/L 농도에서 독성이 관찰되었다[ 22]. 과산화수소의 경우 순환식 양액재배에 적용된 사례는 아직 많지 않다. 과산화수소는 액체 혹은 입자 형태로 판매되며 물에 녹인 후 주입장치(injector)를 이용하여 공급한다. 과산화수소의 산화력이 강하기 때문에 주입장치와 보관용기의 부식에 유의하여야 한다[ 29]. 과산화수소 살균공정은 초기 시설비용은 저렴하지만 운영비용은 상대적으로 높은 편이다( Table 6, 7).
4. 국내외 순환식 수경재배 시스템
국외 순환식 수경재배 시스템 전문기업으로는 네덜란드의 프리바(priva), 미국의 Rough Brothers, 스위스 Plantabon 등이 있다. 그 중 네덜란드의 프리바의 양액재배 시스템은 국내외 온실재배에 가장 많이 사용되는 대표적인 기업이다. 프리바는 온실환경 제어시스템의 선두주자로 물과 영양을 공급하는 설비, 온실의 실내 공기 온도, 습도, 무기염류의 양, 잔류 수분량 등을 컴퓨터로 확인할 수 있도록 하는 자동 제어 시스템을 공급한다[ 58]. Fig. 4(a)는 프리바의 수경재배용수 공급 시스템 개략도를 나타낸다. 순환식 수경재배 용수 공급 과정을 살펴보면, 먼저 폐양액과 빗물, 지하수, 지표수 등의 양액의 원수를 혼합하기 전에 pH 조절 및 살균 공정을 거치게 된다. 다음으로 양액 관리 시스템으로 혼합된 용수 내의 부족한 비료성분을 보충 후 작물에 공급한다. 작물에 공급된 양액의 25~30%가 배액되며 이는 다시 살균 공정을 거친 후 양액 원수를 보충하게 된다. Fig. 4(b)는 프리바의 폐양액 살균 시스템 공정도이다. 프리바의 순환식 양액재배 시스템은 UV-C 살균방식을 적용하며, UV의 투과율을 높이기 위해서 UV공정 전단에 모래여과 전처리 공정을 적용한다( Fig. 4(b), (c), (d)). UV와 함께 과산화수소를 주입하면 OH라디칼을 형성시켜 살균력을 향상 시킬 수 있기 때문에 과산화수소 주입을 함께 사용하기도 한다[ 58]. 유럽과 미국에서는 아쿠아포닉스(aquaponics)라는 기술을 친환경 순환식 양액재배 500 m 2 규모 시스템에 적용하고 있다[ 59]. 아쿠아포닉스는 양액재배와 어류 양식을 결합한 시스템이다. 물고기 배설물인 암모니아가 미생물에 의해 질산염으로 전환되고, 질산염은 다시 수경재배에서 작물의 영양분으로 흡수되어 물이 정화된다. 정화된 물은 다시 어류 양식에 사용되기 때문에 양식을 위한 물 사용량과 양액재배 비료 사용량을 줄이며, 사용한 물의 배출이 없어 환경적인 측면에서도 긍정적인 효과를 얻을 수 있다. 유럽 과학기술협력(European Cooperation in Science and Technology (COST))의 ‘The EU Aquaponics Hub’에 따르면 아쿠아포닉스를 식물성장에 필요한 영양소의 50%이상을 어류 양식 배출물로 충당하는 시스템으로 정의한다[ 59]. 국외에서는 순환식 양액재배 시스템 연구 및 상업화가 활발한 반면, 국내에는 순환식 양액처리 시스템을 제공하는 기업이 많지 않다. 수경재배 관련 국내 기업에는 우일팜, (주)신한에이텍, (주)우성하이텍, (주)동우 등이 있다. 이들 기업들은 주로 자동화 양액 공급장치를 전문적으로 개발/공급하는데 중점을 두고 있으며, 수처리 공정은 모래여과 및 UV 공정을 사용한다. 프리바 시스템의 높은 설치비용에도 불구하고 국내 기업과의 기술 격차로 국내에는 다수의 프리바 시스템 설치되어 있다. 국외 기업이 주도하고 있는 순환식 수경재배 시스템 시장에서 국내 점유율을 높이기 위해서는 국내 수경재배 실정에 적합한 순환식 양액재배용 수처리 기술 개발이 필요하다.
5. 국내 순환식 수경재배 시스템 연구현황 및 미래방향
국내 환경문제에 대한 인식과 관심이 높아지고 있고, 세부적인 폐양액 관리규제가 마련될 것으로 전망되어, 국내 양액 순환식 수경재배 기술 확보가 필요하다. NTIS(국가과학기술지식정보서비스)를[ 60] 활용한 순환식 수경재배 관련 주요 연구를 분석한 결과, 국내에는 국립원예특작과학원, 국립농업과학원, (주)신한에이텍, 한국과학기술원, 서울대학교 등 공공기관, 중소기업 및 대학에서 순환식 수경재배 시스템연구를 추진하였다( Table 8). 국내 순환식 수경재배 연구들은 주로 i) 양액 재순환을 위한 살균 장치 연구, ii) 양액관리 장치 및 프로그램 개발, iii) EC 및 pH 등 센서 개발에 집중되어 있다. 최근 순환식 수경재배 시스템 기술 연구는 스마트 팜 기술개발과 연계하여 수행되고 있는데, 한국과학기술연구원 SFS (Smart Farm Solution) 융합연구단에서는 물 절약을 위한 순환식 양액 살균기술 및 배양액 처리기술에 대한 연구를 진행하였다. 모래여과와 유사한 여재 기반의 전처리 시스템과 UV-C LED를 결합한 보급형 수경재배 시스템 개발과 배액관리 및 양액 제어프로그램 개발을 병행하여 양액재이용에 따른 이온 불균형을 해소하고자 한다[ 60]. 농촌진흥청에서는 열교환기를 이용해 예비가열과 냉각을 동시에 하고 전기가열을 통해 70℃ 이상 올리는 전기 가열식 양액 살균장치를 개발하였다[ 61]. 이 장치는 양액제어 프로그램을 설치하여 살균된 배액 혼합율 및 희석 농도를 설정 가능하게 하였으며 EC 및 pH 제어를 모니터링하여 최적값으로 제어하도록 하였다. 보급률 향상을 위해 수입산 대비 20%의 설치비용이 되도록 개발한 것이 특징이다. 이외에 가시광 응답형 산화타이타늄 광촉매활용 기술(경북대), 플라즈마-UV 복합 소독 공정(대구대), 전기충격 살균법(상명대) 등 양액 살균 신기술 개발도 진행되었다( Table 8). 국내 순환식 수경재배 시스템 보급률을 높이기 위해서는, 순환식 수경재배 수처리 기술 개발 시 우리나라의 수경재배 특성을 고려하여야 할 것이다. 가장 중요하게 고려해야하는 요소는 시스템의 가격 및 규모이다. 국내의 수경재배는 면적 측면에 있어서는 세계적으로 작은 규모는 아니지만, 농가당 평균 면적은 0.5 ha 수준으로 네덜란드의 최소허용 온실 면적인 4.5 ha인 것을 감안하면 영세한 규모이다[ 5]. 1 ha의 토마토 양액재배에서 배양액의 30%의 배액된다고 가정하면 27 m 3/일의 폐양액이 발생하게 되므로[ 17], 우리나라는 대부분 소규모 순환식 수경재배 수처리 시스템이 요구된다( Table 7). 따라서 국내에는 소규모 농가에서도 도입 가능한 저비용의 순환식 수경재배 수처리 시스템이 개발되어야 한다. 모래여과나 이를 개량한 여재 기반 수처리 공정이 초기 시설비용 및 운영비용 측면에서 저렴하므로 국내 여건에 적합할 것으로 판단된다. 그리고 필요시 UV 살균장치를 도입하여 양액의 살균 안정성을 높이는 것도 가능하다. 최근 UV 램프의 단점인 취급 중 깨짐 문제, 램프에 포함된 수은으로 인한 처분시 안전성 문제, 양액 온도 상승 등의 문제를 해결할 수 있는 UV-LED가 주목을 받고 있다[ 62]. 하지만 현재로써는 UV-LED는 고가의 연구단계 기술 수준으로 폐양액 처리 적용에는 한계가 있다. 저가의 LED UV-C 램프 기술이 개발된다면 UV 살균 공정이 보다 경쟁력을 갖출 것으로 기대된다. 폐양액 처리공정은 수처리 관련 비전문 농가에서도 운영 및 유지관리 할 수 있도록 개발하는 것이 중요하다. 따라서 현장에 관리가 어려운 화학약품을 배치해야하거나, 안전설비가 필요한 설비는 소규모 국내 시설에 적절하지 않다. 최근 주목 받고 있는 IoT 기술을 순환식 양액시스템에 접목시킴으로써 현장의 공정 상태를 전문기관에서 유지 관리하는 방법도 현장 운영 인력 및 교육비용을 줄일 수 있는 방안이 될 것이다.
소독 처리된 폐양액의 양은 필요배양액의 30% 수준이므로 70%는 새로 보충할 필요가 있다. 소독 후에 양액의 이온 조성이 달라질 수 있기 때문에, 식물 생장에 적합한 양액 조성으로 유지 관리하는 장치 및 프로그램과 양액 조성을 정밀하게 측정할 수 있는 센서가 필수적이다. 양액에 포함된 개별 영양분 성분을 측정하지 않고, 일반적으로 센서 비용을 낮추기 위해 EC와 pH를 측정하여 양액을 관리한다. 정밀하고 저렴한 EC 및 pH 센서와 주요성분 센서개발은 양액 재이용의 활성화에 도움을 줄 것으로 판단된다.
6. 결 론
세계적으로 물 부족 문제, 비순환식 양액재배로 인한 비점 오염원 문제, 그리고 스마트 팜 시장 형성으로 폐양액 재이용기술에 대한 관심이 높아지고 있다. 이러한 시점에서 순환식 양액재배 기술은 농업용수 절약과 작물재배에 사용되는 질소, 인 등의 비료 사용량을 줄일 수 있는 친환경 기술로 활용가치가 높다. 수경재배가 발달한 네덜란드 및 유럽은 순환식 수경재배 시스템 보급율이 95% 이상이지만[ 5], 국내에는 5% 미만으로 낮다[ 7, 13]. 향후 국내 환경규제를 대비하고 순환식 양액재배 관련 국내 시장 기술 점유율을 높이기 위해서는 한국형 순환식 양액재배 수처리 기술개발이 필요하다. 수경재배가 발달한 네덜란드 달리 우리나라 농가 온실 규모는 1 ha 이하의 소규모 농가가 많다[ 5]. 때문에 국내에는 병원균 살균력뿐 아니라 비용측면에서 경제성 있고, 운영이 쉬운 순환식 수경재배 시스템 개발이 필요하다. 현재 기술 수준에서는 설치 및 운영비용이 상대적으로 낮은 여재기반의 전치리 살균장치가 가장 적합할 것으로 판단되며, 필요시 살균을 보완하는 UV 살균장치를 함께 도입하는 것이 국내 순환식 양액재배 시스템에 적합할 것으로 판단된다. 소규모 양액처리에 적합한 살균 수처리 신기술 개발과 더불어 IOT 기술도입과 정밀하고 저렴한 수질 센서 기술 개발도 병행되어 시스템의 유지관리 편리성 및 안정성을 높이는 노력도 함께 해야 할 것이다.
Acknowledgments
본 연구는 한국기계연구원의 재원과 경북대학교 기본연구사업의 지원을 받아 수행된 연구입니다.
Fig. 1.
Trend of hydroponic production area in Korea [ 3, 4]. 
Fig. 2.
Images of Pythium myriotylum (a) Typical clusters of large appressoria, (b) Oogonium with several antheridia. Bars 20 µm [ 23]. 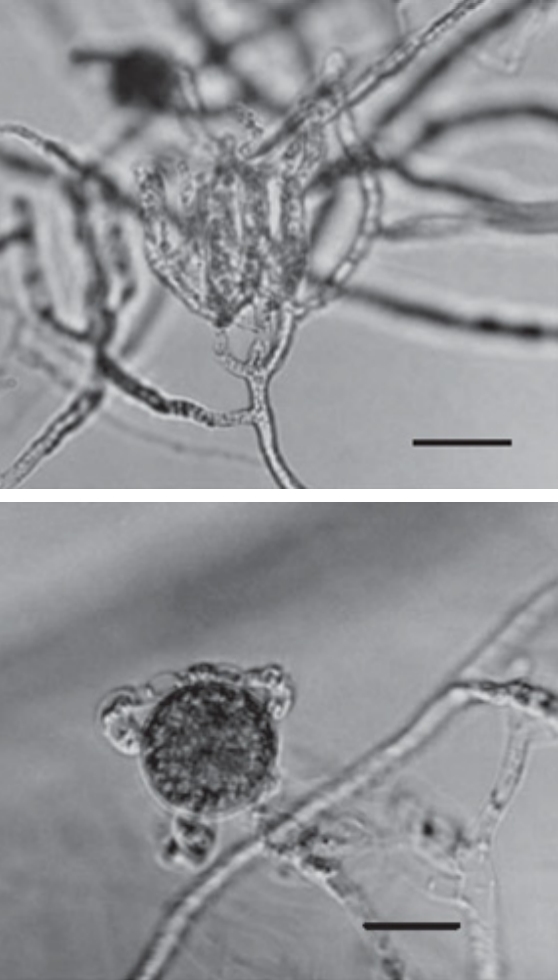
Fig. 3.
Comparison of membrane pore size and size of harmful contaminants [ 50]. 
Fig. 4.
Representative closed hydroponic system from Priva. (SF: sand filter, UVCH: UV chamber, AC: acid, DR: drain silo, DIS: disinfected silo, A: line with disinfected water, C: return line for startup/cool down) [ 58], (a) Schematic overview of the greenhouse water cycle, (b) Disinfection process, (c) Sand filtration, (d) UV disinfection system. 
Table 1.
Hydroponic production area in the world. [ 5, 6]
|
Country |
Hydroponic production area (ha) |
Year |
|
Spain |
8,000 |
2010 |
|
Netherlands |
7,000 |
2010 |
|
Turkey |
4,600 |
2010 |
|
France |
2,700 |
2010 |
|
Belgium |
2,300 |
2010 |
|
Japan |
2,004 |
2016 |
|
Germany |
1,860 |
2010 |
|
Italy |
1,240 |
2010 |
|
England |
560 |
2010 |
Table 2.
Consumption of water and nutrients in open and closed hydroponic system. [ 14]
|
Plant |
Type |
Water use (ton/ha/year) |
Nutrient consumption (kg/ha/year)
|
|
N |
P |
K |
Ca |
Mg |
S |
|
Paprika |
open |
10,115 |
2,102 |
355 |
2,601 |
1,503 |
365 |
504 |
|
closed |
7,229 |
1,125 |
217 |
1,476 |
676 |
187 |
223 |
|
Rose |
open |
15,391 |
1,603 |
376 |
2,038 |
1,079 |
262 |
447 |
|
closed |
10,769 |
981 |
239 |
1,073 |
734 |
116 |
217 |
|
Kalanchoe |
open |
7,206 |
1,047 |
334 |
1,393 |
1,761 |
284 |
184 |
|
closed |
4,229 |
640 |
220 |
883 |
1,156 |
224 |
126 |
Table 3.
Maximum element concentration in raw water for hydroponic solution. [ 17]
|
Element |
Maximum concentration (mg/L) |
Element |
Maximum concentration (mg/L) |
|
NO3-N |
60 |
Fe |
10 |
|
P |
30 |
Mn |
1 |
|
K |
80 |
Zn |
1 |
|
Ca |
80 |
B |
0.7 |
|
Mg |
40 |
Na |
80 |
|
Cl |
200 |
|
|
Table 4.
The amount of nutrients for 100 times concentrated Yamazaki tomato nutrient solution in 1 m 3 of water. [ 19]
|
Tank |
Nutrients |
Amount in 1 m3 of water for 100 times concentrated |
|
A |
KNO3
|
20.2 kg |
|
Ca(NO3)2・4H2O |
35.4 kg |
|
Fe-EDTA |
1.53 kg |
|
B |
KNO3
|
20.2 kg |
|
NH4H2PO4
|
7.6 kg |
|
MgSO4・7H2O |
24.6 kg |
|
H3BO3
|
144 g |
|
MnSO4・4H2O |
81 g |
|
ZnSO4・7H2O |
9 g |
|
CuSO4・5H2O |
4 g |
|
Na2MoO4・2H2O |
1 g |
Table 5.
Concentrations of 5 major nutrients in Yamazaki nutrient solution for different crops. [ 17]
|
Crop |
Nutrient Concentration (mg/L)
|
|
N |
P |
K |
Ca |
Mg |
|
Tomato |
98.0 |
61.9 |
156.4 |
60.1 |
24.3 |
|
Strawberry |
70.0 |
46.5 |
117.3 |
40.1 |
12.2 |
|
Paprika |
126.1 |
77.4 |
234.6 |
60.1 |
24.3 |
|
Cucumber |
182.1 |
92.9 |
234.6 |
140.3 |
48.6 |
Table 6.
Summary of advantages, disadvantages and installation cost for disinfection technologies. [ 1, 24]
|
Process |
Advantages |
Disadvantages |
General Installation cost |
|
Slow sand filtration |
∙Low capital cost |
∙High space requirement |
Medium |
|
∙Removal efficiency varies with pathogen |
|
Heating |
∙High disinfection efficiency |
∙High capital cost and operation cost |
Medium |
|
UV light |
∙Low space requirement |
∙Disinfection efficiency drops with high turbidity and bulb age |
High |
|
∙Interaction with micronutrients such as EDTA-Fe |
|
Membrane |
∙High disinfection efficiency |
∙Frequent plugging, membrane fouling |
High |
|
∙High capital cost |
|
Chlorination |
∙High disinfection efficiency |
∙Side effects on plants |
Medium |
|
Ozone |
∙High disinfection efficiency |
∙High capital cost |
High |
|
∙Disinfection efficiency drops with high organic matter |
|
∙Interaction with micronutrients such as Fe and Mn |
|
Hydrogen peroxide |
∙Low capital cost |
∙Disinfection efficiency drops with high organic matter |
Low |
|
∙Weak disinfection efficiency |
Table 7.
Comparison of operation cost for closed hydroponic systems. Unit: thousand Korean won per day. [ 25~ 30]
|
Process |
Small (29-38 m3/day) |
Medium (34-134 m3/day) |
Large (117-151 m3/day) |
General Remarks |
|
Slow sand filtration |
N.A. |
N.A. |
N.A. |
Very low |
|
Heating |
N.A. |
N.A. |
N.A. |
High |
|
UV light |
0.5-4 |
0.5-7 |
0.5-8 |
Low |
|
Membrane (UF) |
5-7 |
6-24 |
21-27 |
Low |
|
Chlorination |
N.A. |
N.A. |
N.A. |
Low |
|
Ozone |
0.9-2 |
0.9-3 |
1-3 |
Low |
|
Hydrogen peroxide |
19-24 |
20-66 |
60-77 |
Medium-High |
Table 8.
Major researches for closed hydroponics in Korea. [ 60]
|
Research project title |
Research institute |
Disinfection process |
Research topic |
Year |
|
Performance verification and nutrient control program development of circulating hydroponic cultivation system |
Korea institute of science and technology |
∙Media filtration |
∙Nutrient management system and program |
2019 |
|
∙UV LED |
|
Development of control system under EC-based nutrient solution in closed-loop soilless culture |
Jeju national Univ. |
- |
∙Ion sensor |
2018-2020 |
|
∙Nutrient management system and program |
|
Development of recycling system for hydroponic solution |
Shinhan A-TEC Co. Ltd. |
∙UV |
∙Disinfection of nutrient solution |
2017 |
|
∙Nutrient management system and program |
|
Development of disinfection system for hydroponics using glass fiber photocatalyst |
Daejeon health institute of technology |
∙Glass fiber photocatalyst |
∙Disinfection of nutrient solution |
2015 |
|
Development of closed hydroponic technologies with an environment-friendly substrate in cultivation of fruit vegetables for exportation |
Sangmyung Univ. |
∙Electrical disinfection |
∙Disinfection of nutrient solution |
2014-2016 |
|
Application of keeping and growing the frozen young strawberry plants for improving production and recycling drained nutrient for hydroponically grown strawberry |
Hwasun agricultural technology center |
∙UV |
∙Disinfection of nutrient solution |
2013-2014 |
|
∙Nutrient management system and program |
|
Development of Korean-type aquaponics system |
SELab. Inc. |
∙Aquaponics |
∙Sensor for water quality measurement |
2013-2015 |
|
Real-time intelligent control of hydroponic nutrients for plant factory |
Seoul national Univ., Rural development administration, National institute of horticultural and herbal science |
- |
∙Ion sensor |
2012-2014 |
|
∙Nutrient management system and program |
|
∙Data acquisition and communication module |
|
Development of disinfection system for hydroponics using visible-light responsive titanium dioxide |
Kyungpook national Univ. |
∙TiO2 photocatalyst |
∙Disinfection of nutrient solution |
2004 |
References
1. D. L.. Ehret, B.. Alsanius, W.. Wohanka, J. G.. Menzies, R.. Utkhede, Disinfestation of recirculating nutrient solutions in greenhouse horticulture, Agronomie., 21(4), 323-339(2001).  2. K.-R.. Yoo, S.-Y.. Lee, J.-H.. Bae, Effects of nutrient solution composition and cutting size on growth of virus-free sweet potato plant in nutrient film technique, Kor. J. Hort. Sci. & technol., 30(6), 686-693(2012).
3. Status of greenhouse and vegetable production in 2010 Korean Ministry of Agriculture, Food and Rural Affairs(2001).
4. Status of greenhouse and vegetable production in 2017 Korean Ministry of Agriculture, Food and Rural Affairs(2018).
5. H.. Rhee, Necessity and challenge project of closed-system in the hydroponics32(Suppl II), pp. 31-32(2014).
6. H.. Suzuki, Current state and challenges of greenhouse horticulture in Japan, Japan and the Netherlands Horiculture Seminar, Japan Grenhouse Horiculture Association. (2018).
8. H.. Jeon, Y.. Lee, Hydroponics Technology, pp. 507-512(2013).
9. M. Y.. Roh, Nutrient solution recycling in closed hydroponics, Kor. Res. Soc. Protected Hort., 16, 35-42(2003).
10. R.. Rajesh Kumar, J.. Young Cho, Reuse of hydroponic waste solution, Environmental science and pollution research international., 21(16), 9569-9577(2014).  11. Enforcement rule of the water environment conservation Act, Article 34. Ministry of Environment, Korea(2018).
12. Enforcement rule of environment-friendly agriculture promation Act, Article 9. Ministry for Food, Agriculture, Forestry and Fisheries, Korea(2013).
13. D.-C.. Jang, K.-Y.. Choi, K.-H.. Yeo, I.-S.. Kim, Effect of reused cocopeat substrate on growth and yield of summer-cultivated paprika in EC-based recycling hydroponic cultivation, Protected Horticulture and Plant Factory., 26(2), 100-107(2017).  14. J. Y.. Cho, B. S.. Seo, S. J.. Chung, Present status and prospect of sterilization of nutrient solution for recycled hydroponics, Kor. J. Hort. Sci. & Technol., 18(5), 890-899(2000).
15. N.. Sharma, S.. Acharya, K.. Kumar, N.. Singh, O.. Chaurasia, Hydroponics as an advanced technique for vegetable production: An overview, J. Soil. Water Conserv., 17(4), 364-371(2019).  16. L. I.. Trejo-Téllez, F.. Gómez-Merino, Nutrient Solutions for Hydroponic SystemsHydroponics - A Standard Methodology for Plant Biological Researches. T.. Asao(Ed.), InTech, London, pp. 1-22(2012).
17. K.. Cho, S.. Nam, C.. So, All about hydroponics RGB Press, Seoul, pp. 204-210(2013).
18. L.. Dufour, V.. Guérin, Nutrient solution effects on the development and yield of Anthurium andreanum Lind. in tropical soilless conditions, 105, 269-282(2005).  19. B.. Lee, H.. Park, J.. Kim, Y.. Kim, S.. Han, Hydroponics Human culture arirang, Seoul, pp. 115-163(2017).
20. I.. Lakhiar, X.. Liu, G.. Wang, J.. Gao, Experimental study of ultrasonic atomizer effects on values of EC and pH of nutrient solution, Int. J. Agr. Biol. Eng., 11(5), 59-64(2018).  21. J. J.. Jiménez, J. E.. Sánchez, M. A.. Romero, L.. Belbahri, A.. Trapero, F.. Lefort, M. E.. Sánchez, Pathogenicity of Pythium spiculum and P. sterilum on feeder roots of Quercus rotundifolia, Plant Pathology., 57(2), 369-369(2008).  22. R. E.. Raudales, J. L.. Parke, C. L.. Guy, P. R.. Fisher, Control of waterborne microbes in irrigation: A review, Agr. Water Manage., 143, 9-28(2014).  23. H.. Watanabe, Y.. Taguchi, M.. Hyakumachi, K.. Kageyama, Pythium and Phytophthora species associated with root and stem rots of kalanchoe, J. Gen. Plant Pathol., 73(2), 81-88(2007).  25. Y.. Zheng, S.. Dunets, Slow sand filtration Greenhouse and nursery water treatment informatiokn system, Univ. of Guelph, Ontario, pp. 1-9(2012).
26. Y.. Zheng, S.. Dunets, D.. Cayanan, UV light Greenhouse and nursery water treatment informatiokn system, Univ. of Guelph, Ontario, pp. 1-7(2012).
27. Y.. Zheng, D.. Cayanan, S.. Dunets, Chlorination Greenhouse and nursery water treatment informatiokn system, Univ. of Guelph, Ontario, pp. 1-9(2012).
28. Y.. Zheng, S.. Dunets, D.. Cayanan, Ozonation Greenhouse and nursery water treatment informatiokn system, Univ. of Guelph, Ontario, pp. 1-8(2012).
29. Y.. Zheng, S.. Dunets, D.. Cayanan, Stabilized hydrogen peroxide Greenhouse and nursery water treatment informatiokn system, Univ. of Guelph, Ontario, pp. 1-6(2012).
30. S. S.. Yoo, K. H.. Chu, I.-H.. Choi, J. S.. Mang, K. B.. Ko, Operating cost reduction of UF membrane filtration process for drinking water treatment attributed to chemical cleaning optimization, J. Environ. Manage., 206, 1126-1134(2018).  31. A. C.. Schuerger, W.. Hammer, Use of cross-flow membrane filtration in a recirculating hydroponic system to suppress root disease in pepper caused by pythium myriotylum, Phytopathology., 99(5), 597-607(2009).  32. H.-K.. An, S.-J.. Park, Applicability assessment of carbon nanotube to slow sand filtration for bacteria removal, J. Korean Soc. Environ. Eng., 36(12), 873-878(2014).  33. W.. Wohanka, H.. Luedtke, H.. Ahlers, M.. Luebke, Optimization of slow filtration as a means for disinfecting nutrient solutions, Acta Hort., 481, 539-544(1999).  34. W. T.. Runia, A review of possibilities for disinfection of recirculation water from soilless cultures, Acta Hort., 382, 221-229(1995).  35. G. M.. McPherson, M. R.. Harriman, D.. Pattison, The potential for spread of root diseases in recirculating hydroponic systems and their control with disinfection, Horiculture International., 60, 371-379(1995).
36. S. D.. Lee, Recycling soilless systems, Kor. J. Hort. Sci. Technol., 32(Suppl II), 31-32(2014).
37. S.. Morita, A.. Namikoshi, T.. Hirata, K.. Oguma, H.. Katayama, S.. Ohgaki, N.. Motoyama, M.. Fujiwara, Efficacy of UV irradiation in inactivating Cryptosporidium parvum oocysts, Appl Environ Microbiol., 68(11), 5387-5393(2002).  38. S.. Kim, M.. Kwon, Y.. Yoon, Y.. Jung, T.-M.. Hwang, J.-W.. Kang, Determination of efficient operating condition of UV/H2O2 process using the OH radical scavenging factor, J. Korean Soc. Environ. Eng., 36(8), 534-541(2014).  39. S. v.. Haute, I.. Sampers, L.. Jacxsens, M.. Uyttendaele, Selection Criteria for Water Disinfection Techniques in Agricultural Practices, Crit. Rev. Food Sci. Nutr., 55(11), 1529-1551(2015).  40. S.. Schalk, V.. Adam, E.. Arnold, K.. Brieden, A.. Voronov, H.-D.. Witzke, UV-lamps for disinfection and advanced oxidation -lamp types, technologies and applications, IUVA News., 8, 32-37(2006).
41. I.-H.. Lee, J.-S.. Park, S.-W.. Kim, J.-M.. Cha, K.-J.. Choi, B.-G.. Lee, Disinfection of coliform bacteria, fungi and pathogenic bacteria by UV and photocatalytic effects, J. Korean Soc. Environ. Eng., 23(3), 473-484(2001).
42. J. C.. Crittenden, R. R.. Trussell, D. W.. Hand, K. J.. Howe, G.. Techobanoglous, MWH's water Treatsdment: Principles and Design, 3rd ed., John Wiley & Sons, Inc, Hoboken, NJ, pp. 844-846(2012).
43. J.. Cho, Y.-K.. Chung, S.-H.. Kim, NOM rejection and flux decline during membrane filtration of raw water, J. Korean Soc. Environ. Eng., 21(6), 1119-1127(1999).
44. N. P.. Goldberg, M. E.. Stanghellini, S. L.. Rasmussen, Filtration as a method for controlling Pythium root rot of hydroponically grown cucumbers, Plant Disease., 76(8), 777-779(1992).  45. P.. Shloberg, G.. Owen, Populations of propagules of Penicillium spp. during immersion dumping of apples, Canadian Plant Disease Survey., 70(1), 11-14(1990).
46. T.. Ohtani, A.. Kaneko, N.. Fukuda, S.. Hagiwara, S.. Sase, Development of a membrane disinfection system for closed hydroponics in a greenhouse, J. agric. Res., 77(2), 227-232(2000).
47. M.. Moens, G.. Hendrickx, Drainwater filtration for the control of nematodes in hydroponic-type systems, Crop Protection., 11(1), 69-73(1992).  48. M.. Liu, A. K.. Lau, K. V.. Lo, Ultrafiltration tests for the reutilization of greenhouse wastewater, Journal of Environmental Science and Health, Part B., 34(6), 1101-1110(1999).  51. D. F.. Cayanan, P.. Zhang, W.. Liu, M.. Dixon, Y.. Zheng, Efficacy of chlorine in controlling five common plant pathogens, HortScience., 44(1), 157-163(2009).  52. A.. Rosner, O.. Lachman, M.. Pearlsman, L.. Feigelson, L.. Maslenin, Y.. Antignus, Characterisation of cucumber leaf spot virus isolated from recycled irrigation water of soil‐less cucumber cultures, Annals of Applied Biology., 149(3), 313-316(2006).  53. J.. Hoigné, H.. Bader, The role of hydroxyl radical reactions in ozonation processes in aqueous solutions, Water Res., 10(5), 377-386(1976).  54. C.. Hayes, L.. Evans, P.. Fisher, A.. Frances, R.. Vetanovetz, Y.. Zheng, Combat pathogens, algae, with ozone treatment, Greenhouse Manage. Prod., 29, 16-20(2009).
55. T.. Graham, P.. Zhang, Y.. Zheng, M. A.. and Dixon, Phytotoxicity of aqueous ozone on five container-grown nursery species, HortScience., 44(3), 774-780(2009).  56. E.-S.. Abdou, A. A.. Galal, Sensitivity of Fusarium moniliforme, F. solani and F. oxysporum to superoxide anion and hydrogen peroxide In Vitro, Egypt. J. Microbiol., 32, 523-535(1997).
57. J.. Coosemans, Control of algae in hydroponic systems, Acta horticulturae., 382, 263-268(1995).  58. A.. Lee, N.. Enthoven, R.. Kaarsemaker, Best Practice Guidelines for Greenhouse Water Management GRODAN & Priva(2016).
59. H. W.. Palm, U.. Knaus, S.. Appelbaum, S.. Goddek, S. M.. Strauch, T.. Vermeulen, M.. Haїssam Jijakli, B.. Kotzen, Towards commercial aquaponics: a review of systems, designs, scales and nomenclature, Aquac. Int., 26(4), 813-842(2018).  62. X.. Li, M.. Cai, L.. Wang, F.. Niu, D.. Yang, G.. Zhang, Evaluation survey of microbial disinfection methods in UV-LED water treatment systems, Sci. Total Environ., 659, 1415-1427(2019). 
|
|














