전산화 공정에 의한 microcystin 용출 및 고도처리에 의한 제거 특성
Release of Microcystin from Microcystis sp. by Pre-Oxidation and Removal of Microcystin by Advanced Drinking Water Treatment
Article information
Abstract
목적
하절기 고농도의 Microcystis sp. 함유 원수가 정수장으로 유입시에 전산화 공정에서의 microcystin (MCs) 용출과 후단의 고도 정수처리 공정에서 용출된 MCs의 제거 가능성 평가가 목적이다.
방법
고농도 Microcystis sp. 함유원수(400,000 cells/mL)를 이용하여 전염소와 전오존 처리에 의한 MCs 용출 특성을 평가하였으며, 후단의 고도 정수처리 공정인 O3, O3/H2O2, UV/H2O2 및 BAC 공정에서의 전산화 처리에 의해 용출된 MCs 제거 특성을 평가하였다.
결과 및 토의
전염소 투입농도가 증가할수록 수중으로 용출된 MCs 농도는 급격히 증가하다가 염소 투입농도 5 mg/L 이상에서는 감소하였고, 용출된 MCs의 대부분은 MC-RR (57∼86%)과 MC–LR (11∼29%)이 차지하였다. 전염소 처리 이후 전오존 처리공정에서 오존 투입농도가 증가할수록 수중의 MCs 농도는 처리 전에 비해 수∼수십 배 정도 증가하였으나, 전염소를 3 mg/L 이상으로 처리한 경우에는 오존 투입농도가 증가할수록 MCs가 급격히 제거되었다. 전산화 처리 후, 응집-침전 처리수 중의 MCs 농도가 처리 전에 비하여 2배 이상 급격히 증가였으며, 침전공정 동안 산화제에 손상된 Microcystis 조체에서 MCs가 지속적으로 유출되었다. 후산화 공정에서는 O3과 O3/H2O2 공정이 UV/H2O2 공정에 비해 MCs 제거에 효과적이었고, O3과 O3/H2O2 공정에서 1 mg/L 이상으로 O3을 투입한 경우 MCs가 100% 제거되었다. BAC 공정에서는 MCs 유입농도가 각각 0.8 µg/L와 2.8 µg/L일 때 EBCT 15분에서 각각 100%와 93% 제거되었으며, MC-RR에 비해 MC-LR의 생물분해 제거능이 낮았다. 고농도의 MCs가 유입되거나 MC–LR의 구성비율이 높을 경우에는 BAC 공정의 EBCT를 증가시켜 운전할 필요가 있었다.
결론
고농도 Microcystis sp. 함유 원수를 전산화 처리하면 고농도의 MCs이 용출되었으나 후단의 O3, O3/H2O2, UV/H2O2 및 BAC 공정과 같은 고도 정수처리 공정에서 제거가 가능하였다. 특히, UV-AOP 공정에 비해 O3 공정에 의한 MCs 제거율이 높았으며, BAC 공정에서도 EBCT 15분의 조건에서는 93∼99%의 MCs가 제거되었다. Microcystis sp.가 번성하는 시기에 응집/침전 공정의 효율 증진을 위해 전산화 공정을 적용하는 정수장에서는 후단에 O3/BAC 공정을 적용할 경우 MCs 제거에 매우 효과적으로 나타났다.
Trans Abstract
Objectives
The objectives of this study were to evaluate the characteristics of microcystins (MCs) release form Microcystis sp. in surface water during pre-oxidation process using chlorine and ozone and it’s removal by advanced water treatment process as post process when raw water containing high Microcystis sp. is introduced into the water treatment plant.
Methods
Raw water which had contained over 400,000 cells/mL of Microcystis sp. were used to evaluate the characteristics of MCs released from Microcyctis sp. and chlorination (Cl2) and ozonation (O3) were used as pre-oxidation process and O3, O3/H2O2, UV/H2O2 and biological activated carbon (BAC) were used as post oxidation process.
Results and Discussion
As the concentration of chlorine increased, the concentration of released MCs in the water increased, but decreased when higher than 5 mg/L of chlorine dosage. Released MCs were consisted of almost MC-RR (57∼86%) and MC–LR (11∼29%). In the ozone treatment after prechlorination process, the MCs concentration was increased by several fold to dozen fold to compare before ozonation. However, when chlorine dosage was over 3 mg/L, MCs were rapidly removed as the ozone concentration increased. The MCs concentration of flocculation/sedimentation treated sample after the pre-oxidation was increased more than two times before treatment, the MCs was continuously released during the coagulation/sedimentation process from the damaged Microcystis sp. due to the prior oxidation process. In the post-oxidation process, O3 and O3/H2O2 processes were more effective for removing MCs than the UV/H2O2 process, and O3 and O3/H2O2 processes removed 100% of the MCs when O3 was added above 1 mg/L. 100% and 93% were removed respectively at 15 minutes of EBCT (empty bed contact time) in the BAC process, when the MCs concentrations of influent were 0.8 µg/L and 2.8 µg/L. The biodegradability of MC-LR was lower than that of MC-RR. It was necessary to increase the EBCT of the BAC process when the concentrations of MCs or the ratio of MC-LR were high.
Conclusions
Although, pre-oxidation treatment to the raw water containing high concentration of Microcystis release higher MCs concentration in the oxidized water, that can be removed by post O3, O3/H2O2, UV/H2O2 and BAC processes. The removal rate of MCs by O3 process was higher than that of UV-AOP process, and 93∼99% of MCs removed with 15 min of EBCT in BAC process. In the drinking water treatment plant where the pre-oxidation process is applied to improve the efficiency of the flocculation/sedimentation process during the blooming season of Microcystis sp., O3/BAC process after the flocculation/sedimentation process is recommendable to MCs remove.
1. 서 론
최근 기후변화 영향에 따른 수온 상승으로 인해 상수원에서 조류 수화(water bloom)에 의한 수질악화가 문제시되고 있다. 조류는 상수원으로 이용되는 강이나 하천, 호소 등에 항상 잔존하면서 수중의 영양염류의 농도, 일사 조건 및 수온과 같은 생태적인 인자들이 충족될 경우 짧은 시간 내에 대량으로 번성하게 된다.
낙동강 하류에 위치한 부산의 상수원인 물금과 매리지역에서도 강 하류의 특성상 수중에 잔존하는 풍부한 영양염류로 인하여 중・상류지역의 상수원에 비해 상대적으로 매년 조류 문제로 어려움을 겪고 있다. 낙동강 하류에 서식하는 조류의 생체량과 상수원 수질의 장기변동 특성에 대해 연구한 Son의 연구결과들[1,2]에 의하면 낙동강 하류에는 연중 다양한 조류종들이 상시 서식하며 원수의 성상에 많은 영향을 미치고 있으며, 주로 5월~11월에는 남조류종인 Microcystis sp.가 우점하며, 12월~4월까지는 규조류종인 Synedra sp.와 Stephanodiscus sp.가 우점하는 것으로 보고하고 있다.
상수원에 조류가 대량으로 증식하여 정수장 유입원수에 조류의 개체수가 급격히 증가하게 되면 정수장 운영측면에서 여러 가지 장애요인들이 발생한다. 원수의 pH 상승 및 유기물질 농도증가로 응집제 투입량이 증가되고[3], 침전지에서 완전히 제거되지 못한 조류와 조류 플록이 후속공정인 급속 모래여과지로 유입되어 여과지의 조속한 폐색을 유발하여[4] 역세척 주기가 단축되어[5] 정수장에서 운영비 증가와 생산량 감소 등에 영향을 미친다. 특히, 하절기에 Microcystis sp.와 같은 남조류가 대량 번식할 경우 남조류종들이 분비하는 microcystin (MC)과 같은 조류독소 물질들과 냄새유발 물질들이 수돗물의 안전성과 신뢰성을 위협한다[6~8].
심미적인 영향을 유발하여 수돗물의 신뢰성을 떨어뜨리는 냄새유발 물질들과는 달리 조류독소 물질들은 인체에 건강상의 위해를 가하는 것으로 알려져 있다[9]. 대표적인 남조류 독소물질인 MC는 환상형 헵타펩타이드 군의 하나이며, 가장 독성이 강한 MC-LR 및 MC–RR, MC-YR 등을 포함하여 100여개의 구조적 유사체를 가지고 있다[10]. MC은 단백질 인산 가수분해효소(protein phosphatase)의 억제제로 작용하며, 포유류의 간에 강한 독성을 유발할 뿐만 아니라 포유류에 대해 생식독성(reproductive toxicity)을 유발하는 것으로 알려져 있다[11~13].
미국에서는 음용수에서의 MC에 대한 건강 권고 농도를 유아와 취학 전 아동을 대상으로는 0.3 µg/L 이하, 학령기 아동과 성인 대상으로는 1.6 µg/L 이하로 설정하여 운영하고 있으며[14], 세계보건기구(WHO)에서는 음용수에 잔존하는 MC 농도가 1 µg/L가 초과하지 않을 것을 권장하고 있다[15].
Microcystis sp. 세포들은 정전기적 반발력과 입체효과에 의해 수중에서 안정적으로 존재하기 때문에 기존 정수처리 공정에서는 Microcystis sp. 세포들에 대한 높은 제거효율을 기대하기가 어려운 실정이다[16~18]. 따라서 최근에는 응집/침전/여과 공정에서의 Microcystis sp. 제거효율을 증진시키는 방안[19]뿐만 아니라 다양한 산화공정[20,21] 및 멤브레인 공정[22]을 이용하여 Microcystis sp.의 제거효율을 높이기 위한 다양한 연구들이 수행되었다. 특히, 다양한 산화제를 이용하여 정수처리 공정에서 Microcystis sp.의 제거효율을 증진시키려는 연구결과들에서는 산화처리에 의해 Microcystis sp.의 세포파괴(cell lysis)로 세포 내에 존재하는 MC이 세포 밖으로 용출되어 수중의 MC 농도가 증가하는 것으로 보고하고 있다[23~26].
국내 대부분의 대규모 정수장에서는 암모니아성 질소와 철・망간의 제거, 조류 사멸 및 침전지 수질 개선 등을 위하여 불가피하게 염소나 오존을 이용한 전산화(pre-oxidation) 공정을 운영하고 있다[27]. 하절기 상수원에 Microcystis sp.의 개체수가 폭발적으로 증가하면 플록의 침전능 증진을 위하여 정수장에서는 산화제 투입농도를 증가시킨다[27]. 이때 수중으로 고농도의 MC가 용출되어 후단 공정들에서 충분히 제거되지 못할 경우에는 수돗물에서 문제를 야기할 가능성이 높다.
본 연구에서는 남조류인 Microcystis sp.의 개체수가 많은 원수에 대해 전산화 공정에서의 MC 용출 특성과 용출된 MC에 대해 오존과 자외선을 이용한 고도 산화공정 및 생물활성탄(biological activated carbon, BAC) 공정에서의 제거 특성도 함께 평가하였다. 조류 문제로 많은 어려움을 겪는 정수장의 설계 및 운영에 대한 기초자료를 제공하는 것이 본 연구의 목적이다.
2. 실험재료 및 방법
2.1. 고농도 조류 원수 조제
Microcystis sp.의 개체수가 높은 시기(2019년 8월)에 낙동강 하류 매리지역에서 조류 거름망(체 눈금:5µm)을 이용하여 조류 생시료를 채집하였으며, 채집한 조류 생시료와 매리원수를 80 L 용량의 원형 물통에 혼합하여 Microcystis sp.의 개체수가 대략 400,000 cells/mL (클로로필-a 농도:450 mg/m3)가 되도록 고농도 조류 원수를 조제하였다. 고농도 조류 원수의 탁도와 DOC 농도는 각각 96 NTU와 4.9 mg/L였다.
2.2. 산화 실험
산화 실험은 전산화 실험과 후산화 실험으로 나누어 수행하였다. 전산화 실험은 고농도 조류 원수를 다양한 농도의 염소와 오존을 투입하여 산화처리에 따른 MC 용출농도를 조사하였으며, 후산화 처리의 경우는 전산화 처리가 끝난 시료수를 응집-침전-GFC 여과 후에 다양한 조건에서 O3, O3/H2O2 및 UV/H2O2 실험을 수행하여 수중에 잔류하는 MC 농도를 조사하였다.
실험에 사용된 염소는 염소가스를 순수에 직접 용해시킨 염소수(1,400 mg・Cl2/L)를 사용하였으며, 오존의 경우도 고순도 산소를 이용하여 오존발생기(LAB-1, OzoneTech, Korea)로 생성시킨 가스상 오존을 순수에 직접 용해시킨 오존수(40~50 mg・O3/L)를 실험에 사용하였다.
전산화 실험 및 응집-침전실험은 jar-tester (Phipps & Birds, USA)에서 수행하였으며, 2 L jar에 고농도 조류 원수를 투입하여 염소(0~5 mg/L) 접촉 후에 오존(0~3 mg/L)을 투입하였으며, 염소와 오존 접촉시 30 rpm으로 교반하면서 투입된 산화제와 조류 시료들이 잘 혼합되도록 하였다.
전염소와 전오존 접촉시간은 실제 정수장의 전염소 및 전오존 공정과 유사하도록 각각 1시간과 10분으로 고정하여 실험하였다.
후산화 실험은 O3, O3/H2O2 및 UV/H2O2 실험으로 나누어 수행하였다. O3과 O3/H2O2 실험은 300 mL BOD병에 시료수를 투입한 후 과산화수소(35%, Hanwha Chemical, Korea)와 오존을 실험조건에 알맞게 투입하였으며, 접촉시간은 정수장의 후오존 처리공정과 유사한 조건인 20분으로 하였다. 반응시간 20분 동안 자석젓개를 교반하여 투입한 산화제들이 시료수와 완전히 혼합되도록 하였다. UV 산화실험은 저압 수은램프(254 nm, Phillips, USA) 2개가 장착된 collimate beam 장치를 사용하였으며, pyrex 유리재질의 페트리디쉬(D: 8.5 cm, H: 5 cm)에 시료수 200 mL를 채운 후 자석젓개를 천천히 교반하면서 상부에서 UV광을 조사하였다. 목적 UV 조사량에 필요한 UV 조사시간은 radiometer (UVX Radiometer, UVP, USA)로 측정한 UV 강도를 atrazine actinometry 방법[28,29]에서 산출된 보정계수로 보정하여 250~1500 mJ/cm2 범위에 대한 UV 조사시간을 결정하였다.
2.3. 응집-침전 실험
응집-침전 실험은 jar-tester (Phipps & Birds, USA)에서 전염소와 전오존을 이용한 전산화 처리가 끝난 후에 연속적으로 수행되었으며, 응집제는 alum (Al2O3:8% 이상, 홍원산업)를 사용하였고, 투입농도는 최적의 탁도 제거율을 나타낸 80 mg/L로 하였다. 교반 및 침전은 응집제 투입 후 100 rpm의 교반속도로 급속 혼화 3분, 30 rpm으로 완속 혼화 15분 및 침전 1시간의 조건으로 수행하였다.
2.4. 생물활성탄(BAC) 실험
BAC 공정에서의 수중의 MC 제거능 평가는 신탄을 아크릴 컬럼(내경:2.5cm)에 충진한 후 2년 정도 운전한 것을 사용하였으며, 비교 평가를 위해 2년 정도 운전한 안트라사이트가 충진된 biofilter 컬럼을 동시에 운전하였다. 고농도 조류 원수를 전산화 처리 후 응집-침전시켜 GF/C 여지로 여과한 것을 정량펌프를 사용하여 아크릴 컬럼의 상부로 유입시켜 EBCT 5분~15분의 조건으로 실험하였다.
2.5. Microcystin (MC) 분석
수중에 잔존하는 MC 농도분석에는 onlineSPE가 장착된 UPLC-OrbitrapMS (Thermo, Exactive Plus, USA)를 사용하여 총 7종의 MC (MC-LR, -RR, -YR, -LA, -LY, -LF 및 –LW)을 정성・정량하였다. 정성・정량에 사용된 7종의 MC 표준물질은 분말상(100 µg)으로 된 Enzo사(USA) 제품을 사용하였다. Online SPE-UPLC-Orbitrap MS의 분석조건을 Table 1과 Table 2에 나타내었다.
3. 결과 및 고찰
3.1. 전산화 공정에 의한 MC 용출 특성
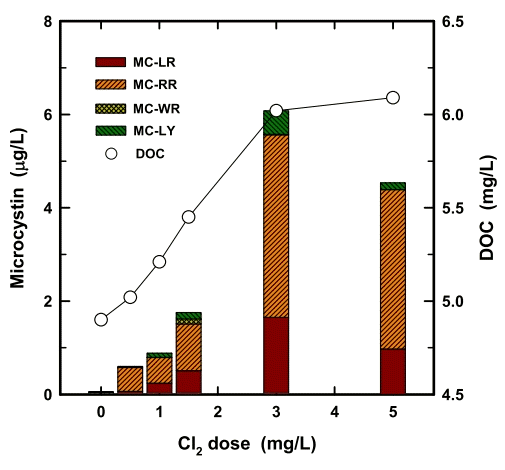
Microcystis sp.의 개체수가 대략 400,000 cells/mL인 고농도 조류 원수에 대해 전산화 공정으로 투입되는 염소 투입농도에 따라 수중으로 용출된 MC와 DOC 농도변화를 Fig. 1에 나타내었다. 염소 투입농도별로 수중으로 용출된 MC 농도를 살펴보면 염소 투입 전에는 53 µg/L의 MC가 수중에 잔존하였으나, 염소 투입농도가 0.5 mg/L, 1 mg/L, 1.5 mg/L, 3 mg/L 및 5 mg/L로 증가할수록 수중의 MC 농도도 각각 0.60 µg/L, 0.88 µg/L, 1.75 µg/L, 6,08 µg/L 및 4.54 µg/L로 급격히 증가하였다. 수중으로 용출된 MC의 대부분은 MC-RR (57~86%)과 MC–LR (11~29%)이었으며, 이들 두 물질이 전체 MC 농도에서 차지하는 비율은 거의 86~97%에 해당하였다. 염소 투입농도 5 mg/L에서는 3 mg/L의 염소를 투입한 경우에 비하여 수중으로 용출된 MC 농도가 오히려 감소하였다.
염소 투입농도별로 수중으로 용출된 DOC 농도변화의 경우는 염소 투입농도가 증가할수록 지속적으로 증가하는 경향을 나타내었다. 특히, 염소농도 3 mg/L까지는 수중으로 용출된 DOC 농도변화가 염소 투입농도에 비례하여 거의 직선적으로 증가하였으나 그 이상의 투입농도에서는 수중으로 용출된 DOC 농도의 큰 증가경향은 나타나지 않았다.
원수에 Microcystis sp. 개체수 농도가 높을 경우, 전산화 공정에서 투입되는 산화제 농도가 증가할수록 Microcystis sp.의 세포파괴로 인하여 수중으로 용출되는 MC 및 AOM의 농도는 점진적으로 증가하지만 일정 농도 이상에서는 Microcystis sp.의 세포막은 완전히 손상되어 조체 내에 잔존하는 MC와 AOM이 대부분 수중으로 용출되고, 용출된 MC는 수중에 잔존하는 산화제에 의해 산화되어 MC 농도는 감소[21,30]하였으나 AOM 농도는 큰 변화를 나타내지 않는다.
전산화 공정에서 염소 투입농도별 Microcystis sp. 군집의 형태적 특성변화를 살펴보기 위해 현미경으로 200배 확대하여 촬영한 것을 Fig. 2에 나타내었다. Fig. 2에서 볼 수 있듯이 염소 투입농도가 증가할수록 Microcystis sp. 군집 내 Microcystis sp. 개체들에서 세포내 구성물질의 용출로 인해 세포 안이 투명하게 변하였으며, 염소 투입농도 3 mg/L (Fig. 2(c))과 5 mg/L (Fig. 2(d))의 조건에서는 군집 내 대부분의 Microcystis sp. 개체들의 색깔이 투명하게 변한 것을 볼 수 있다. 이러한 세포 내 구성물질(IOM)의 용출로 인해 Fig. 1에서 볼 수 있듯이 수중의 MC와 DOC 농도가 증가하였다.
낙동강 하류에 위치한 대규모 정수장들은 전산화 공정으로 염소뿐만 아니라 오존도 병용하고 있다. 따라서 전염소 처리 후 오존 투입농도에 따른 수중으로의 MC 용출특성을 평가한 것을 Fig. 3에 나타내었다. Fig. 3에서 볼 수 있듯이 다양한 농도로 염소를 투입하여 1시간 접촉 후, 오존을 최대 3 mg/L까지 투입하여 전염소 처리에 의해 수중으로 용출된 MC의 농도변화를 평가하였다.
Fig. 3(a)~(f)에서 볼 수 있듯이 전염소 투입농도 1.5 mg/L까지(Fig. 3(a)~(d))는 전오존 투입농도가 증가할수록 지속적으로 수중의 MC 농도가 증가하였으며, 전염소 처리 후 전오존 처리를 거친 수중의 MC 농도는 오존처리 전과 비교하여 수~수십 배 정도 증가하였다. 그러나, 전염소 투입농도 3 mg/L 이상(Fig. 3(e)~(f))의 경우에서는 전염소 처리에 의해 수중으로 대부분의 MC가 용출되었기 때문에 전오존 처리에 의해 이미 수중으로 용출된 MC가 오존 투입농도가 증가할수록 급격히 산화되어 제거되는 것으로 나타났다.
낙동강 하류에 위치한 대규모 정수장들에서 전오존 투입시설의 설계용량은 2 mg/L 정도이며, 평상시에는 1 mg/L 정도의 오존을 투입하고 있다. Fig. 3(e)와 (f)에서와 같이 전염소 처리에 의해 고농도의 MC가 수중으로 용출된 경우, 1 mg/L의 오존 투입농도에서는 47~54% 정도의 MC 제거율을 나타내었고, 2 mg/L의 오존 투입농도에서는 59~86%의 MC 제거율을 나타내었다. 그러나 전술하였듯이 1.5 mg/L 이하의 전염소 처리에 의해서는 후단의 전오존 처리로 인해 수중으로 MC의 용출이 더욱 가속화되는 것으로 나타나 상수원수에서 Microcystis sp. 개체수가 급격히 증가하는 시기에 전산화 공정을 구비한 정수장에서는 전산화 공정을 배제하고 정수장을 운영하는 것이 간독성 유발물질인 MC에 대해 안전한 수돗물 생산방법으로 평가되었으나 전산화 공정을 배제하여 정수장을 운영하면 응집 플록의 침전능 저하로 인하여 급속 모래여과의 잦은 역세척으로 인해 현저한 생산량 감소로 인하여 하절기에 폭발적으로 증가하는 수돗물 수요를 충족시키기가 어렵다. 그렇기에 정수장에서는 응집 플록의 침전능 개선을 목적으로 3 mg/L 이상의 전염소와 1 mg/L 이상의 전오존을 투입하여 운전하지만 투입된 염소와 오존의 투입농도가 부족할 경우, Fig. 3에서 볼 수 있듯이 수중에 고농도로 용출된 MC로 인해 후단공정의 운전에 더욱 악영향을 미칠 수 있다.
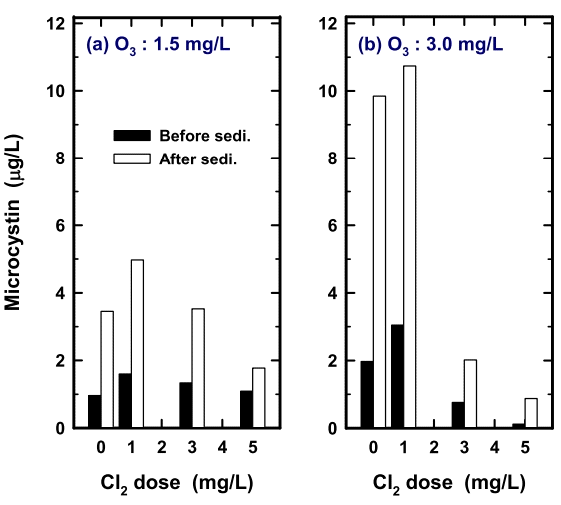
전산화 공정을 거친 시료수를 이용하여 응집-침전 공정 전・후의 MC 농도변화를 평가한 것을 Fig. 4에 나타내었다. Fig. 4(a)에는 다양한 농도로 전염소 처리한 후, 전오존 1.5 mg/L 처리한 시료수를 응집-침전처리 하였을 때 처리 전・후의 수중의 MC 농도를 비교한 결과를 나타내었다. 전반적으로 응집-침전 공정을 거치고 난 시료수의 MC 농도가 처리 전에 비하여 2배 이상 급격히 증가였으며, 특히 전염소 투입 농도가 낮을수록 이러한 경향은 더욱 뚜렷하게 나타났다. 특히, Fig. 4(a)와 동일한 실험조건에서 전오존 투입농도만 3 mg/L로 하여 수행한 경우에는 응집-침전 공정 이후 수중의 MC 농도는 이전에 비해 3~4배 정도로 더 증가하는 경향을 나타내었다. 이러한 현상은 저농도(1 mg/L 이하)로 투입한 염소가 Microcystis sp. 세포와 반응하여 세포 손상에 거의 소모되지만 비교적 고농도로 투입된 염소는 침전지 후단까지 수중에 잔류하며 산화처리에 의해 손상된 Microcystis sp. 조체에서 용출되는 MC를 지속적으로 산화・제거하기 때문으로 판단된다.
Fig. 4(a)와 (b)에서 볼 수 있듯이 특히 1 mg/L 이하로 전염소 처리한 경우에서 침전공정 이후에 MC 농도증가 현상이 두드러진 것으로 나타났으며, 이는 Fig. 2(a)와 (b)에서 볼 수 있듯이 1 mg/L 이하로 전염소 처리한 경우에는 염소처리에 의해 Microcystis sp. 세포들의 손상이 미미하였고, 후단의 오존처리에 의해 추가적인 Microcystis sp. 세포들의 손상이 유발되었을 가능성이 높다. 잔류성이 없는 오존은 전오존 공정에서 소모되며, 침전지로 유입된 손상된 Microcystis sp.에서 지속적으로 MC가 용출되어서 Fig. 4와 같은 결과로 나타났다. Ho 등의 연구결과[31]에서도 정수장 침전지에서의 남조류 독소농도 증가현상을 보고하고 있다. 따라서 이러한 현상을 방지하기 위해서는 응집/침전 공정에서의 체류시간을 줄여서 손상된 Microcystis sp. 세포로부터 MC 유출량을 감소시키는 것이 중요한 것으로 나타났다.
3.2. 고도처리에 의한 MC 제거
후산화 공정에서의 MC 제거능 평가를 위해 오존과 UV 공정을 사용하여 과산화수소 투입 유무에 따른 MC 제거능을 평가한 것을 Fig. 5에 나타내었다. 후산화 공정 실험에 사용된 시료수는 전산화 공정과 응집-침전공정을 거친 후 GF/C 여지를 사용하여 여과한 시료를 사용하였으며, MC 초기 농도는 2.8 µg/L였다.
후산화 공정에서 MC 제거능 평가를 위해 O3과 O3/H2O2 공정(O3:H2O2=2:1)을 적용한 결과를 Fig. 5(a)에 나타내었다. Fig. 5(a)에서 볼 수 있듯이 O3과 O3/H2O2 공정에서의 MC 제거능은 매우 높게 나타났다. O3을 0.5 mg/L의 농도로 투입한 경우에 MC 제거율은 97% 이상으로 나타났고, H2O2를 첨가한 경우에는 거의 99%에 가까운 제거율을 보였다. 1 mg/L 이상의 O3 투입농도에서는 O3과 O3/H2O2 공정을 적용한 모든 결과들에서 MC가 100% 제거되었다. 이런 결과로 판단해 볼 때 고농도의 MC가 유입되더라도 후오존 공정에서 비교적 높은 MC 제거율을 나타낼 것으로 판단되었다.
또한, 후산화 공정으로 UV/H2O2 공정을 적용하여 MC 제거능을 평가해 본 결과를 Fig. 5(b)에 나타내었다. 전체적으로 O3과 O3/H2O2 공정과 비교하여 비교적 낮은 제거율을 나타내고 있으며, 동일한 UV 조사량에서 H2O2의 투입농도를 5 mg/L에서 10 mg/L로 증가시켰을 경우에 MC 제거율은 4~15% 정도 상승하였다. 또한, UV 조사량 1,000 mJ/cm2에서 90% 이상의 제거율을 얻기 위해서는 10 mg/L의 과산화수소 투입이 필요하였다.
BAC와 biofilter 공정에서의 EBCT 변화에 따른 MC 제거능을 평가한 것을 Fig. 6에 나타내었다. BAC와 biofilter 공정에서의 MC 생물분해 실험에는 유입농도를 각각 0.8 µg/L와 2.8 µg/L 두 조건으로 실험하였다. Fig. 6(a)와 (b)에서 볼 수 있듯이 유입농도가 2.8 µg/L로 비교적 높을 경우, BAC와 biofilter 공정에서 EBCT 5~15분에서의 제거율은 각각 55~93% 및 13~31%로 나타난 반면, 유입되는 MC 농도가 0.8 µg/L일 때는 EBCT 5~15분에서의 제거율이 각각 88~100% 및 35~64%로 나타나 MC 유입농도에 따른 제거율에 비교적 많은 차이를 나타내었다. 또한, 유입수 중에 MC-LR과 MC–RR의 농도가 각각 0.8 µg/L과 2.0 µg/L으로 MC-RR의 농도가 높았으나 BAC 공정에서 EBCT 5분~15분에서의 제거율은 각각 30~79% 및 66~99%로 나타나 MC-RR에 비해 MC-LR의 생물분해 제거율이 낮았다.
후산화 공정과 BAC 공정은 전산화 공정에서 용출된 MC의 제거에 있어서 재래식 처리공정의 한계를 극복할 수 있는 매우 효과적인 공정으로 평가되었으며, 현재 이러한 목적으로 가장 널리 이용되고 있는 공정이다[32].
4. 결 론
1) 전염소 투입농도가 증가할수록 수중으로 용출된 MC 농도는 급격히 증가하다 염소 투입농도 5 mg/L 이상에서는 감소하였으며, 용출된 MC의 대부분은 MC-RR (57~86%)과 MC–LR (11~29%)이었다.
2) 전염소 처리 후단의 전오존 처리공정에서 오존 투입농도가 증가할수록 수중의 MC 농도는 처리 전에 비해 수~수십 배 정도 증가하였으나, 전염소를 3 mg/L 이상으로 처리한 경우에는 오존 투입농도가 증가할수록 MC가 급격히 제거되었다.
3)전산화 처리 후, 응집-침전 처리수 중의 MC 농도가 처리 전에 비하여 2배 이상 급격히 증가였으며, 침전공정 동안 산화제에 손상된 Microcystis 조체에서 MC가 지속적으로 유출되었다.
4) 후산화 공정에서는 O3과 O3/H2O2 공정이 UV/H2O2 공정에 비해 MC 제거에 효과적이었고, O3과 O3/H2O2 공정에서 1 mg/L 이상으로 O3을 투입한 경우 MC가 100% 제거되었다.
5) BAC 공정에서는 MC 유입농도가 각각 0.8 µg/L과 2.8 µg/L일 때 EBCT 15분에서 각각 100%와 93% 제거되었으며, MC-RR에 비해 MC–LR의 생물분해 제거능이 낮았다. 고농도의 MC가 유입되거나 MC–LR의 구성비율이 높을 경우에는 EBCT의 증가가 필요하였다.