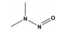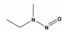낙동강 하류원수를 대상으로 모의 고도 정수처리공정을 이용한 N-Nitrosamine류 제거능 평가
Evaluation of N-Nitrosamines Removal Capability by Using Simulated Advanced Drinking Water Treatment Process for the Downstream of Nakdong River
Article information
Abstract
본 연구에서는 급속모래 여과수와 후오존 처리수에 8종의 nitrosamines (N-nitrosodimethylamine (NDMA), N-nitrosomethylethylamine (NMEA), N-nitrosopyrrolidine (NPYR), N-nitrosodiethylamine (NDEA), N-nitrosopiperidine (NPIP), N-nitrosomorpholine (NMOR), N-nitrosodi-n-propylamine (NDPA), N-nitrosodi-n-butylamine (NDBA))를 투입하여 후오존, 후오존/과산화수소, 자외선, 자외선/과산화수소 및 생물활성탄 공정에서의 제거능을 실험실 규모의 실험장치로 모사하였다. NDMA, NMEA 및 NDEA와 같은 단쇄 nitrosamine류들에 대해 오존 투입농도를 2 mg/L로 하여 정수장에서의 후오존 및 후오존/과산화수소 공정을 모사한 결과, 40% 이하의 낮은 제거율을 나타내었다. 반면 NDPA, NPYR, NMOR, NPIP 및 NDBA와 같은 장쇄 및 지방족 고리구조를 가지는 nitrosamine류들은 40~90% 정도의 비교적 높은 제거율을 나타내었다. 정수장의 후오존 공정을 대체할 목적으로 자외선 단독공정과 자외선/과산화수소 공정에서의 nitrosamine류들에 대한 제거능을 모사한 결과, 자외선 단독공정에서 조사량 500 mJ/cm2과 1000 mJ/cm2일 때의 제거율이 각각 59~96% 및 86~100%로 나타났으며, 자외선/과산화수소 공정에서의 제거율은 UV 단독공정과 거의 유사하게 나타났다. 생물활성탄 공정에서의 nitrosamine류 8종의 제거능을 모사한 결과, 가장 높은 제거율을 나타낸 물질은 NDMA였으며, 수온이 10℃와 25℃일 때 EBCT 15분에서의 제거율이 각각 71%와 94%였으며, 가장 낮은 제거율을 나타낸 NMOR의 경우는 각각 27%와 42%의 제거율을 나타내었다. 생물활성탄 공정에서의 제거율은 NDMA, NMEA, NDEA, NDPA, NDBA, NPYR, NPIP, NMOR 순이었다. 낙동강 하류에 위치한 대규모 정수장에서 nitrosamine류의 효과적인 제어를 위해서는 현재 운영 중인 후오존 및 후오존/과산화수소 공정 보다는 자외선을 기반으로 하는 고도 산화공정이 적합하였으나 후오존 및 후오존/과산화수소 공정의 경우도 후단의 생물활성탄 공정과 조합하여 운영하면 정수장으로 유입된 nitrosamine류에 대해 효율적인 제어가 가능한 것으로 평가되었다.
Trans Abstract
In this study, 8 nitrosamines (N-nitrosodimethylamine (NDMA), N-nitrosomethylethylamine (NMEA), N-nitrosopyrrolidine (NPYR), N-nitrosodiethylamine (NDEA), N-nitrosopiperidine (NPIP), N-nitrosomorpholine (NMOR), N-nitrosodi-n-propylamine (NDPA), N-nitrosodi-n-butylamine (NDBA)) were spiked into rapid sand-filtration water and post-ozone treatment water and the removal efficiencies in post-ozone (O3), O3/hydrogen peroxide (H2O2), ultraviolet (UV), UV/H2O2 and biological activated carbon (BAC) processes were simulated on a laboratory scale. As a result of simulating the O3 and O3/H2O2 processes at the drinking water treatment plant (DWTP) with O3 input concentration of 2 mg/L for short chain-nitrosamines such as NDMA, NMEA and NDEA, the removal efficiency was as low as 40% or less. On the other hand, long chain-nitrosamines and aliphatic cyclic structures such as NDPA, NPYR, NMOR, NPIP and NDBA showed relatively high removal efficiencies of about 40% to 90%. The removal efficiencies of nitrosamines in UV alone and in UV/H2O2 processes were 59~96% (UV dosage: 500 mJ/cm2) and 86~100% (UV dosage: 1000 mJ/cm2), respectively. The removal efficiency of UV/H2O2 process was almost similar to that of UV alone process. In the BAC process, NDMA showed the highest removal efficiency among 8 nitrosamines. The removal efficiencies of NDMA were 71% and 94%, respectively, when water temp. were 10℃ and 25℃ and EBCT was 15 min. In the case of NMOR with the lowest removal efficiencies, the removal rates were 27% and 42%, respectively. The removal efficiencies in the BAC process were in the order of NDMA, NMEA, NDEA, NDPA, NDBA, NPYR, NPIP and NMOR. In order to effectively control of nitrosamines in large scale DWTPs located downstream of the Nakdong River, an advanced oxidation process based on UV is more suitable than the O3 and O3/H2O2 processes currently in operation. In the case of the O3 and O3/H2O2 processes, it was also evaluated that it is possible to efficiently control the nitrosamines introduced into the DWTP when operated in combination with BAC process.
1. 서 론
N-nitrosamine (nitrosamine)류는 고무, 폴리머, 농약, 염료 및 강철 주조 등 다양한 산업에서 직접 사용되거나 부산물로 생성되며[1], 또한 이들은 신종 소독부산물질로 정수장이나 하수처리장에서 소독 또는 산화 목적으로 사용되는 클로라민, 염소 및 오존처리 시에 생성된다[2,3].
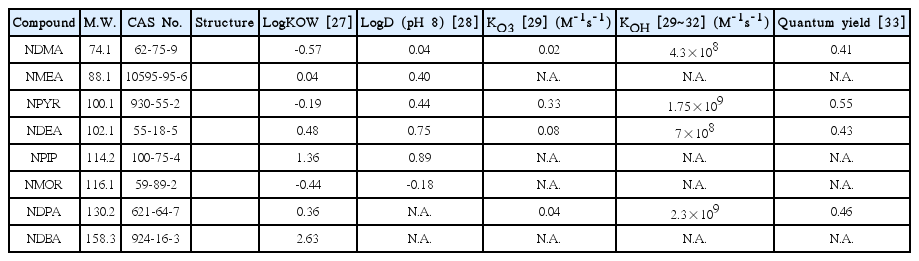
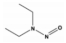
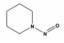
Nitrosamine류는 R1N(-R2)-N=O의 구조를 가지며, N-nitrosodimethylamine (NDMA), N-nitrosodi-n-propylamine (NDPA), N-nitrosodiphenylamine (NDPHA), N-nitrosomethylethylamine (NMEA), N-nitrosodiethylamine (NDEA), N-nitrosopyrrolidine (NPYR), N-nitrosopiperidine (NPIP), N-nitrosodi-n-butylamine (NDBA), N-nitrosomorpholine (NMOR) 등 9종으로 알려져 있다[4]. 이들 중 NDPHA와 NMOR을 제외한 7종은 미국 환경청(US EPA)에서 인체에 발암 가능성이 있는 물질(B2 그룹)들로 분류하고 있으며[5], NDMA를 포함한 몇몇 물질들은 유전독성(genotoxicity)도 나타내는 것으로 보고되고 있다[6]. 특히, N-nitrosamine류 중에서 검출빈도와 농도가 가장 높은 물질은 NDMA이며[7], 세계보건기구(WHO)에서 음용수의 NDMA 가이드라인을 100 ng/L로 설정하고 있다[8].
Nitrosamine류는 dimethylamine (DMA)이나 2차 또는 3차 amine류가 염소계 소독제와 반응하여 생성되며[9,10], 또한 질소 함유 유기화합물, dimethyl기를 포함하는 물질들뿐만 아니라 천연유기물질(natural organic matter, NOM)도 nitrosamine류 생성의 주요 전구물질로 알려져 있다[11,12]. 또한, 하수처리장의 방류수에 함유되어 상수원으로 유입되는 잔류 의약품류, 개인위생용품류 및 주방세제와 같은 가정용품류에 포함된 3차 amine류가 nitrosamine류 생성의 주요 전구물질로 작용한다[13~15].
낙동강 수계에서 nitrosamine류 검출특성에 대해 조사한 Kim 등[4]의 연구결과에서는 9종 중 NDMA, NMEA, NDEA, NDPA, NDBA 및 NDPHA가 검출되었고, 검출농도와 검출빈도는 NDPA가 가장 높았으며, 다음으로 NDBA, NDEA, NDPHA, NMEA, NDMA 순으로 보고하고 있다. 낙동강 본류에서 가장 높은 농도를 나타낸 지점은 중류부근의 대형 하수처리장들의 방류수의 영향을 받는 곳으로 4월과 8월에 각각 82.4 ng/L와 229.9 ng/L의 농도로 nitrosamine류가 검출되었으며, 희석 효과에 의해 하류로 내려올수록 점진적으로 농도가 감소하여 매리지역에서는 4월과 8월에 각각 14.4 ng/L와 35.8 ng/L의 농도로 검출된 것으로 보고하고 있다[4]. 또한, 오염물질들과 조류 사멸을 위해 운영되는 전산화(전염소, 전오존) 공정에 의한 nitrosamine류 생성[16,17] 및 하절기 남조류 번성기에 응집-침전효율 증대 목적으로 사용되는 polyamine [18]에 의한 nitrosamine류의 생성농도 증가[19,20]도 원수에 함유되어 정수장으로 유입되는 nitrosamine류 못지않게 정수장에서의 nitrosamine류 제어에 있어서 문제점으로 작용한다.
Nitrosamine류는 응집, 침전 및 모래여과와 같은 기존 정수처리공정에서 제거하기가 어려울 뿐만 아니라 NDMA와 같은 친수성 nitrosamine류의 경우는 입상활성탄 흡착공정으로도 충분한 제거율을 얻기가 힘들다[21,22]. 고도 산화공정과 역삼투(reverse osmosis, RO) 막공정과 같은 고도 정수처리 공정이 적용되어야 이들의 제거가 가능하다[23,24]. 또한, 최근에는 생물활성탄(biological activated carbon, BAC)과 같은 biofiltration 공정을 적용한 생물학적 처리에 의해서도 nitrosamine류의 효과적인 제거에 대한 연구결과도 보고되고 있다[25,26].
본 연구에서는 현재 낙동강 하류의 대규모 정수장들에 구비되어 있는 오존/과산화수소 및 BAC 공정에서의 nitrosamine류 제거능을 평가하고자 하였으며, 오존/과산화수소 공정의 대체 공정으로 각광받고 있는 자외선/과산화수소 공정에서의 nitrosamine류의 제거능도 함께 평가하였다. 본 연구의 결과를 노후 정수장 선진화 사업의 기초자료로 활용하고자 하였다.
2. 실험재료 및 방법
2.1. 표준물질 및 시료수 조제
실험에 사용된 nitrosamine 8종은 순도 99% 이상의 NDMA, NMEA, NDEA, NDPA, NPYR, NMOR, NPIP 및 NDBA이며, 미국의 Ultra Scientific사와 독일의 Dr. Ehrenstofer사에서 구매하여 사용하였다. 내부표준물질로는 미국 AccuStandard사의 NDMA-d14을 사용하였다.
실험에는 낙동강 하류에 위치한 정수장의 급속 모래여과 처리수(모래여과수)와 후오존 처리수를 채수하여 사용하였으며, 모래여과수 및 후오존 처리수에 nitrosamine류 8종을 각각 100 ng/L의 농도로 희석하여 실험수를 조제하였다. 실험에 사용된 nitrosamine 8종의 물리화학적인 특성을 Table 1에 나타내었다. 또한, 실험에 사용된 낙동강 하류 정수장의 모래여과수와 후오존 처리수의 성상을 Table 2에 나타내었다.
2.2. Nitrosamine류 제거실험
2.2.1. 오존, 오존/과산화수소 및 UV/과산화수소 산화실험
오존, 오존/과산화수소 및 UV/과산화수소 산화실험은 모래여과수에 8종의 nitrosamine류 각각의 농도가 100 ng/L가 되도록 투입하여 실험에 사용하였다. 오존 및 오존/과산화수소 실험은 산소(99.999%)로 오존을 생성하는 오존 발생기(LAB-1, OzoneTech, Korea)를 이용하여 고농도의 오존수(40~50 mg·O3/L)를 제조한 후 시료수 250 mL가 채워진 300 mL BOD병에 고농도 오존을 투입하여 0.5~5 mg/L의 오존 투입 범위로 오존수를 희석하여 실험에 사용하였다. 과산화수소(35%, Hanwha Chemical, Korea)는 오존 투입 전에 오존:과산화수소의 투입비가 2 : 1이 되도록 투입하였다. 오존 접촉시간은 20분으로 고정하여 실험하였으며, 반응시간 20분 동안 자석젓개를 교반하여 투입한 산화제들이 시료수와 완전히 혼합되도록 하였다.
UV 산화실험은 저압 수은램프(254 nm, Phillips, USA) 2개와 공랭식 시스템을 장착한 collimate beam 장치를 사용하였으며, pyrex 유리재질의 페트리디쉬(D : 8.5 cm, H : 5 cm)에 시료수 200 mL를 채운 후 magnetic stirrer를 사용하여 교반하면서 상부에서 UV광을 조사하였다. 목적 UV 조사량에 필요한 UV 조사시간은 radiometer (UVX Radiometer, UVP, USA)로 측정한 UV 강도를 atrazine actinometry 방법[34,35]에서 산출된 보정계수로 보정하여 50~1500 mJ/cm2 범위에 대한 UV 조사시간을 결정하였다.
2.2.2. BAC 생물분해 실험
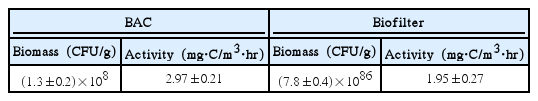
입경 8~30 mesh의 활성탄(석탄계)과 안트라사이트를 labscale (D : 2.5 cm, H : 35 cm) 아크릴 컬럼 세트(6개)에 충진 후 2년 정도 운전한 BAC와 안트라사이트-biofilter를 사용하였다. 8종의 nitrosamine류 생물분해 실험에 이용된 BAC와 안트라사이트-biofilter의 부착 박테리아 생체량과 활성도를 Table 3에 나타내었다.
Lab-scale BAC 및 biofilter 컬럼의 운전은 후오존 처리수에 nitrosamine류 8종을 각각 100 ng/L의 농도로 80 L 용량의 유입수 조에 투입 후 정량펌프를 사용하여 BAC와 biofilter 컬럼들의 EBCT가 각각 5, 10, 15분이 되도록 운전하였다. 6개의 컬럼들은 하향류 방식으로 운전하였으며, 역세척은 각각의 컬럼 하부로 처리수를 공급하여 활성탄 층이 50% 정도 팽창되도록 하여 주 1회 실시하였다. 컬럼 내부의 수온변화는 수온조절 장치를 이용하여 수온을 5~25℃로 조절하였고, 수온 조절 후에는 4주간 변화된 수온에 대한 순응기간을 거친 후 실험을 실시하였다.
2.3. Nitrosamine류 전처리 및 분석
GF/C 여지(Whatman, UK)를 이용하여 시료수 200 mL 중의 입자들을 제거한 후 고체상 추출법(solid phase extraction, SPE)으로 시료수중의 nitrosamine류를 추출하였다. 고체상 추출은 자동 SPE 추출장치(SmartPrep® Automated Cartridge Extractor II, Horizon Technology, USA)를 사용하여 디클로로메탄(DCM)으로 추출하였으며, 추출된 DCM 용액은 자동농축기(DryVap Concentrator System, Horizon Technology, USA)를 이용하여 최종적으로 1 mL가 되도록 농축하였다.
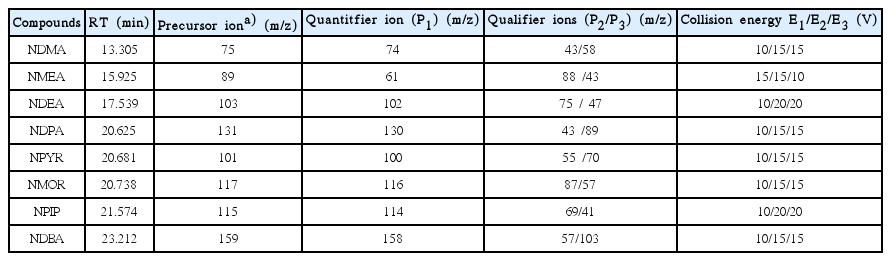
Nitrosamine류 분석에는 GC-MS/MS (GC: Scion 456, MS/MS: Scion TQ, Bruker, USA)를 이용하였으며, 분석조건을 Table 4에 나타내었다. 분석에 사용된 컬럼은 Restek (USA)사의 Rxi-5Sil MS (60 m × 0.25 mm × 1.0 μm)를 이용하였다. 이온화는 chemical ionization (CI) mode를 적용하였고, CI reagent로 메탄을 사용하였으며, collision gas는 Ar (99.999%)을 사용하였다. 9종의 nitrosamine류는 MRM (multiple reaction monitoring) mode로 정량하였으며, MRM 조건들은 Table 5에 나타내었다. Nitrosamine류 8종의 검출한계(LOD)와 정량한계(LOQ)는 각각 0.6~1.6 ng/L 및 2.1~5.0 ng/L 범위였다.
3. 결과 및 고찰
3.1. 오존 및 오존/과산화수소 공정에서의 nitrosamine류 제거 특성
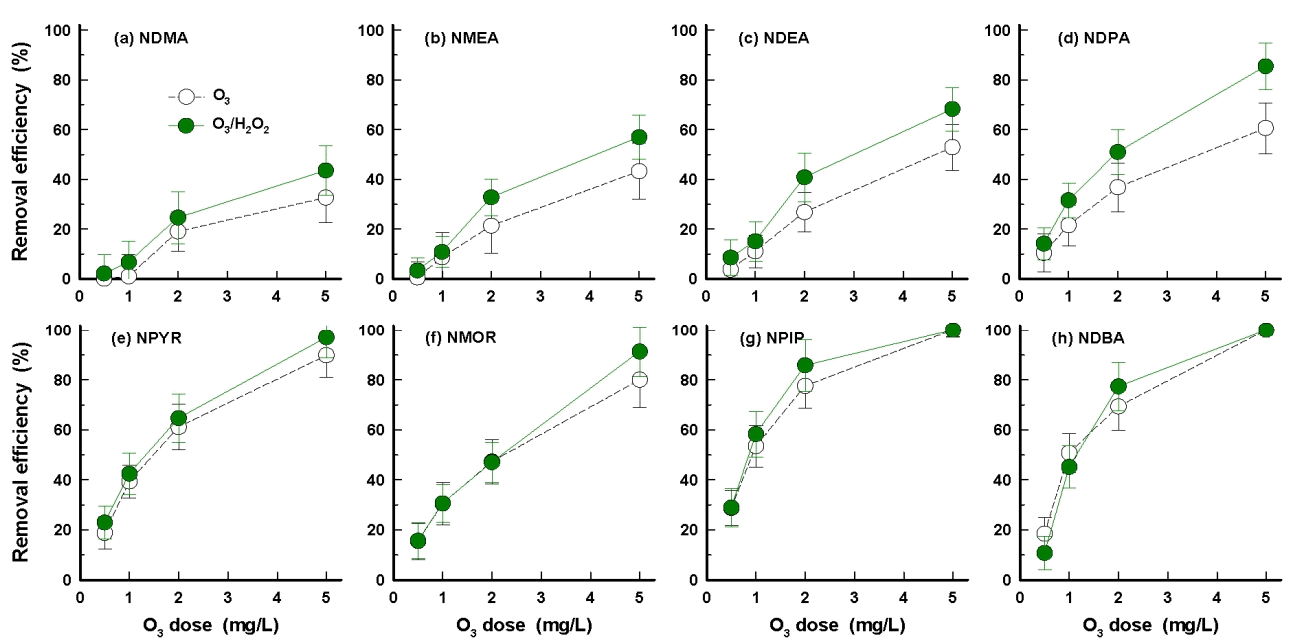
오존 단독공정과 오존/과산화수소 공정에서 다양한 오존 및 과산화수소 투입농도에 따른 8종의 nitrosamine류의 제거율 변화를 Fig. 1에 나타내었다. Fig. 1(a)의 NDMA의 경우, 오존 단독공정에서는 1 mg/L의 투입농도에서 1% 정도의 제거율을 나타내었으며, 오존 투입농도가 2 mg/L와 5 mg/L로 증가할수록 제거율은 각각 19%와 33%로 증가하였다. 오존/과산화수소 공정에서는 오존 1 mg/L와 과산화수소 0.5 mg/L의 조건에서 2% 정도의 제거율을 나타내었으며, 오존 2 mg/L와 과산화수소 1 mg/L와 오존 5 mg/L/과산화수소 2.5 mg/L의 조건에서는 각각 25%와 44% 정도의 제거율을 나타내어 오존 단독공정에 비해 동일한 오존 투입농도에서 소폭이지만 제거율이 상승하였다. Fig. 1(b)와 Fig. 1(c)에 나타낸 NMEA와 NDEA의 경우도 NDMA에 비하여 소폭의 제거율 상승은 나타났으나 오존이나 OH 라디칼에 의한 제거율이 비교적 낮게 나타났다.
반면, Fig. 1(d)~Fig. 1(h)에 나타낸 NDPA, NPYR, NMOR, NPIP 및 NDBA의 경우는 오존 투입농도 1 mg/L에서 21~53%의 제거율을 나타내었으며, 오존 투입농도가 2 mg/L와 5 mg/L로 증가할수록 제거율은 각각 37~78%와 61~100%로 증가하였다. 또한, 오존 1 mg/L와 과산화수소 0.5 mg/L의 조건에서는 31~58% 정도의 제거율을 나타내었으며, 오존 2 mg/L와 과산화수소 1 mg/L및 오존 5 mg/L와 과산화수소 2.5 mg/L의 조건에서는 각각 47~86%와 85~100%의 제거율을 나타내었다. 물질별로 제거율의 차이는 있었으나 NDMA, NMEA 및 NDEA에 비하여 오존 단독공정과 오존/과산화수소 공정과의 제거율 차이는 크지 않아 NDPA, NPYR, NMOR, NPIP 및 NDBA의 경우는 오존이나 OH 라디칼에 의한 제거율은 유사한 것으로 평가되었다.
Nitrosamine류를 구성하고 있는 N-nitroso기와 alkyl chain구조는 오존과의 반응이 비교적 느린 것으로 알려져 있으며[29] 또한, N-nitroso기와 OH 라디칼과의 반응성도 매우 낮은 것으로 보고되고 있다[30~32]. 특히, NDMA, NMEA 및 NDEA와 같은 단쇄 nitrosamine류의 경우 Fig. 1에서 볼 수 있듯이 오존 및 OH 라디칼과의 반응성이 낮아서 저농도의 오존이나 OH 라디칼의 조건에서는 높은 제거율을 기대하기가 어려웠고, 5 mg/L 이상으로 오존 투입농도를 높이거나 오존과 과산화수소 투입농도를 증가시켜 OH 라디칼의 생성율을 상승시킨 경우(오존 5 mg/L와 과산화수소 2.5 mg/L)에는 소폭이지만 제거율 상승을 기대할 수 있었다. 반면 NDPA, NPYR, NMOR, NPIP 및 NDBA와 같은 장쇄 및 지방족 고리구조를 가지는 nitrosamine류들의 경우는 오존이나 OH 라디칼과의 반응속도가 비교적 빠르기 때문에 오존이나 OH 라디칼에 의한 제거율이 단쇄 nitrosamine류에 비하여 상대적으로 높게 나타났다[36~38].
NDPHA와 같은 방향족 고리구조를 가지는 nitrosamine류는 오존 및 OH 라디칼과 매우 높은 반응성을 가지는 것으로 알려져 있다[38]. 또한, 장쇄 nitrosamine류들의 제거율에도 다소 차이가 있었으며, 이는 N-nitroso기 이외의 각 물질을 구성하고 있는 관능기의 차이에서 유발된 결과로 평가되었다[30~32].
낙동강 하류에 위치한 대형 정수장들의 후오존 공정에서 nitrosamine류의 제거를 위해 오존 단독 또는 오존/과산화수소 공정을 운영할 경우, 후오존 공정에서 2 mg/L 이상의 오존을 투입하는 것은 어렵다. 따라서 낙동강 본류에서 검출빈도 및 검출농도가 비교적 높은 6종의 nitrosamine류(NDPA, NDBA, NDEA, NDPHA, NMEA 및 NDMA) [4] 중에서 NDMA, NMEA, NDEA 및 NDPA가 원수에 함유되어 정수장으로 유입될 경우, 후오존 및 후오존/과산화수소 공정에서 효과적인 제거율을 기대하기가 어렵다[23,39].
3.2. UV 및 UV/과산화수소 공정에서의 nitrosamine류 제거 특성
UV 단독공정과 UV/과산화수소 공정에서 다양한 UV 조사량과 과산화수소 투입농도에 따른 8종의 nitrosamine류의 제거율 변화를 Fig. 2에 나타내었다. Fig. 2에서 볼 수 있듯이 UV 단독공정과 UV/과산화수소 공정과의 제거율의 차이는 아주 미미한 것으로 나타나고 있다. 또한, 오존 단독공정과 오존/과산화수소 공정에서 제거율이 비교적 낮았던 NDMA, NMEA 및 NDEA의 제거율이 큰 폭으로 상승한 것을 알 수 있다.
UV 단독공정에서의 8종의 nitrosamine류의 제거율을 살펴보면 UV 조사량 500 mJ/cm2의 경우에는 59~96%의 제거율을 나타내었으며, UV 조사량을 1000 mJ/cm2과 1500 mJ/cm2으로 증가시킨 경우에는 제거율이 각각 86~100% 및 96~100%로 나타났으며, NDMA, NMEA 및 NDEA가 다른 물질들에 비해서 비교적 낮은 제거율을 나타내었다. 또한, UV/과산화수소 공정에서의 제거율은 UV 단독공정에 비해 큰 상승은 나타나지 않고 유사한 제거율을 나타내었다. 따라서 UV/과산화수소 공정에서의 nitrosamine류의 주요 제거 메커니즘이 OH 라디칼에 의한 산화 제거가 아니라 UV광에 의한 광분해(photolysis)이며, nitrosamine류의 N-N=O 결합이 UV광과의 높은 반응성으로 인해 광분해 효율이 높기 때문이다[40,41]. Zhou 등[42]의 연구결과에서도 nitrosamine류의 제거효율 증대를 목적으로 OH 라디칼 생성을 위한 과산화수소 투입은 제거효율 상승에 의미가 없는 것으로 보고하고 있다.
따라서 낙공강 하류에 위치한 대규모 정수장으로 유입된 nitrosamine류 제거를 위해 모래여과 공정의 후단에 UV를 기반으로 하는 산화공정의 적용을 고려 시에 제거율과 운영적인 면을 종합하여 UV/H2O2 공정 보다는 UV 단독공정이 경제적이며 UV 조사량은 최소 1000 mJ/cm2 이상으로 설계되어야 하는 것으로 평가되었다.
3.3. BAC 공정에서의 nitrosamine류 제거 특성
8종의 nitrosamine류에 대한 생물학적 처리공정에서의 제거능 평가를 위해 2년 정도 운전한 BAC와 biofilter 컬럼을 사용하여 수온 10℃와 25℃, EBCT 15분의 조건에서 제거율을 평가한 결과를 Fig. 3에 나타내었다.
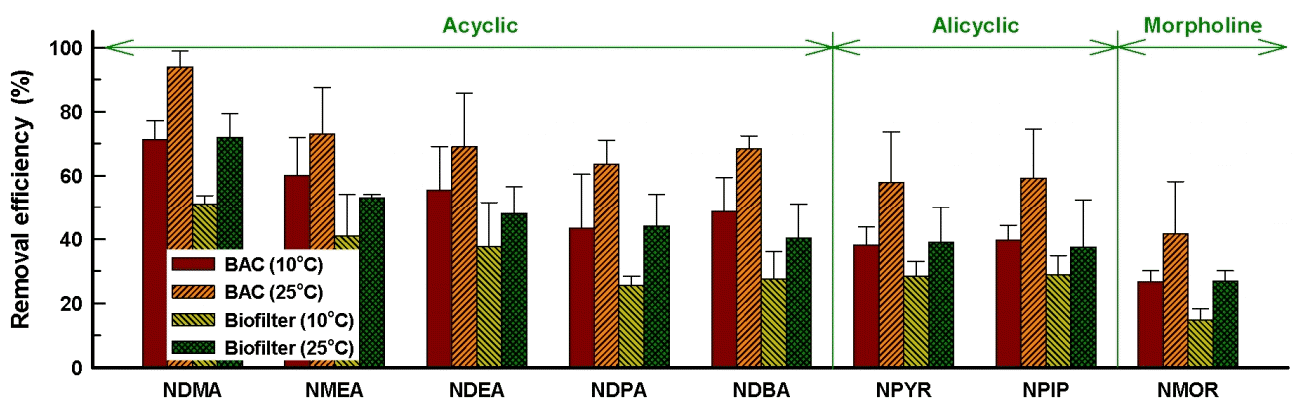
Variation of removal efficiencies according to various water temp. in BAC and biofilter (EBCT: 15 min) .
Fig. 3에서 볼 수 있듯이 BAC와 biofilter에서 가장 높은 제거율을 나타낸 물질은 NDMA였으며, 수온이 10℃와 25℃일 때 BAC에서의 제거율이 각각 71%와 94% 정도로 나타났으며, biofilter에서의 제거율은 각각 51%와 71% 정도로 나타났다. BAC와 biofilter에서의 제거율은 NDMA, NMEA, NDEA, NDPA, NDBA, NPYR, NPIP, NMOR 순으로 나타났다. NDMA는 정수장이나 하수처리장의 급속 모래여과 공정에서도 생물분해가 이루어질 정도로 생물분해가 용이한 것으로 알려져 있다[43,44].
일반적으로 분자 구조가 유사한 물질들의 경우, 분자 구조내의 작용기의 특성에 따라 생물분해에 의한 제거율에 많은 차이가 발생한다[45]. Tadkaew 등[46]은 하수에 함유된 미량 유해물질을 대상으로 MBR (membrane bioreactor) 공정에서의 생물학적 제거능을 평가한 연구결과에서 물질 분자 구조내의 작용기를 전자수용기(electron withdrawing group)와 전자공여기(electron donating group)로 나누어 생물학적 처리효율을 평가한 결과, 물질의 Log D값이 3.2 이하일 때 전자수용기만 가진 물질들의 생물학적 처리율이 20% 이하로 매우 낮았으며, 전자공여기만 가진 물질들의 경우는 70% 이상의 생물학적 처리율을 나타내었다고 보고하고 있다.
호기성 박테리아에 의한 유기성 화합물의 생물분해 단계에서 분자 구조 내에 halogen기 또는 nitro기와 같은 전자수용기(electron withdrawing group)가 존재하는 유기 화합물질은 분자 내에 전자부족을 유발하여 호기성 박테리아에 의한 생물분해 과정에서 강한 저항성을 나타내지만, hydroxyl기 또는 alkyl기와 같은 전자공여기(electron donating group)를 지닌 유기 화합물질은 호기성 박테리아의 산소 분해효소의 전자공여기에 대한 친전자성 공격으로 인해 보다 쉽게 생물분해된다[47].
Nitrosamine류 8종을 분자 구조에 따라 분류하면, acyclic계(NDMA, NMEA, NDEA, NDPA 및 NDBA), alicyclic계(NPYR와 NPIP) 및 morpholine계 (NMOR)로 구분할 수 있으며, 이들은 전자수용기(nitroso기)와 전자공여기(amine기, morpholine기)를 함께 지니고 있다[48]. Nitroso기는 강한 전자수용기인 반면, amine기는 강한 전자공여기[49]로 작용하기 때문에 nitroso기의 존재에도 불구하고 NMOR를 제외한 대부분의 nitrosamine류는 생물학적 처리에 의해 비교적 쉽게 생물분해가 가능하다. NMOR의 경우는 NMOR의 morpholine기에 존재하는 산소 원자가 morpholine기의 전자공여능을 감소시켜 결과적으로 전자수용기인 nitroso기의 영향을 강하게 받아서 8종의 nitrosamine류 중에서 생물분해에 의한 제거율이 가장 낮게 나타났다[48]. 또한, NMOR을 제외한 nitrosamine류들 중에서 alkyl 사슬은 amine기의 전자공여능에 영향을 미치지만 지방족 사슬의 길이가 증가함에 따라 이러한 영향은 감소[49]하기 때문에 분자량이 증가할수록 생물분해 제거율은 감소하였다. 또한, 비환식(acyclic) alkyl-amine은 지환족(alicyclic) alkyl-amine 보다 강한 전자공여능[49]을 가지기 때문에 acyclic계인 NDMA, NMEA, NDEA, NDPA 및 NDBA가 alicyclic계인 NPYR과 NPIP에 비해 비교적 생물분해에 의한 제거율이 높게 나타났다. 결과적으로 8종의 nitrosamine류 중에서 강한 전자공여능을 가지는 2개의 methyl-amine기가 있는 NDMA가 가장 높은 생물분해 제거율을 나타내었다.
4. 결 론
1) NDMA, NMEA 및 NDEA와 같은 단쇄 nitrosamine류들에 대해 오존 투입농도를 2 mg/L로 하여 정수장에서의 후오존 및 후오존/과산화수소 공정을 모사한 결과, 40% 이하의 낮은 제거율을 나타내었다. 반면 NDPA, NPYR, NMOR, NPIP 및 NDBA와 같은 장쇄 및 지방족 고리구조를 가지는 nitrosamine류들은 40~90% 정도의 비교적 높은 제거율을 나타내었다.
2) 정수장의 후오존 공정을 대체할 목적으로 자외선 단독공정과 자외선/과산화수소 공정에서의 nitrosamine류들에 대한 제거능을 모사한 결과, 자외선 단독공정에서 조사량 500 mJ/cm2과 1000 mJ/cm2일 때의 제거율이 각각 59~96% 및 86~100%로 나타났으며, 자외선/과산화수소 공정에서의 제거율은 UV 단독공정과 거의 유사하게 나타났다.
3) 생물활성탄 공정에서의 nitrosamine류 8종의 제거능을 모사한 결과, 가장 높은 제거율을 나타낸 물질은 NDMA였으며, 수온이 10℃와 25℃일 때 EBCT 15분에서의 제거율이 각각 71%와 94%였으며, 가장 낮은 제거율을 나타낸 NMOR의 경우는 각각 27%와 42%의 제거율을 나타내었다. 생물활성탄 공정에서의 제거율은 NDMA, NMEA, NDEA, NDPA, NDBA, NPYR, NPIP, NMOR 순이었다.
4) 낙동강 하류에 위치한 대규모 정수장에서 nitrosamine류의 효과적인 제어를 위해서는 현재 운영 중인 후오존 및 후오존/과산화수소 공정 보다는 자외선을 기반으로 하는 고도 산화공정이 적합하였으나 후오존 및 후오존/과산화수소 공정의 경우도 후단의 생물활성탄 공정과 조합하여 운영하면 정수장으로 유입된 nitrosamine류에 대해 효율적인 제어가 가능한 것으로 평가되었다.