영산강 퇴적물에서 용출되는 용존 유기물의 형광특성 분석
Fluorescence Analysis of Dissolved Organic Matter Released from Sediment of Yeongsan River
Article information
Abstract
본 연구에서는 영산강 죽산보 상류의 퇴적물에서 수층으로 용출되는 용존 유기물을 대상으로 형광분석을 실시하였다. 시료 채취는 2015년 7월 6일 죽산보 상류 0.5 km (YS1)와 1.5 km (YS2)에서 이루어 졌으며, 채취한 퇴적물을 깊이별(T, M, B)로 나누어 20℃에서 7일 동안 배양하였다. 배양한 시료를 대상으로 용존 유기탄소를 측정하고 형광분석을 실시하였다. 용존 유기탄소는 보와 인접하고 입자 크기가 작은 YS1 지점에서 배양에 따라 증가하는 경향을 보였다. 형광분석을 통해 유기물 특성의 지표인 SUVA, HIX, BIX, FI를 계산한 결과 용존 유기물 중 소수성 유기물과 고분자 유기물은 YS1 지점에서 YS2 지점보다 많이 포함되어 있었다. 배양에 따라 퇴적물에서 수층으로 용출되는 용존 유기물은 육상기원 유기물과 미생물 기원 유기물이 혼합된 복합기원 휴믹물질이었다. PARAFAC 분석 결과 제시된 두 가지 성분은 Humic-like와 Tryptophan-like 물질로, 배양에 따라 Humic-like 물질은 두 지점 모두에서 용출되었으며, Tryptophan-like 물질은 YS2 지점에서만 용출되었다. 본 연구의 결과로부터 정체성 수역 내 퇴적물의 유기물 용출 특성이 시간적, 공간적으로 변화함을 알 수 있었고, 이는 향후 정체수역 수질관리를 위한 기초자료로 활용될 수 있다고 판단된다.
Trans Abstract
This study conducted fluorescence analysis of the dissolved organic matter released from the sediments in the upper stream of Juksanbo, Yeongsan River. Sediment samples were obtained at 0.5 km (YS1) and 1.5 km (YS2) upstream of Juksanbo on July 6. 2015. The sediments were divided by depth (T, M and B) and incubated at 20℃ for 7 days. The supernatant of incubated samples was used for the measurement of dissolved organic carbon and fluorescence analysis. The concentration of dissolved organic carbon was higher at YS1 with smaller particle size. As a result of SUVA, HIX, BIX and FI analysis, hydrophobic organic matter and polymeric humic organic matter were contained more in YS1 than YS2. Dissolved organic matter released from the sediment to the water layer with incubation was the terrestrial origin organic matter or the autochthonous organic matter. The parallel factor analysis (PARAFAC) results showed that two fluorescence components: terrestrial Humic-like (C1) and Tryptophan-like (C2) constituted the fluorescence matrices of sediment samples. From the results of this research, there is spatial and temporal variation of the organic matter released from the sediment of the river with weir, which is useful information for the water quality management in the future.
1. 서 론
하천으로 유입된 유기물과 영양염류는 흡착, 침전의 과정을 거쳐 바닥으로 퇴적되고, 퇴적되어 쌓인 물질들은 확산, 재부유 그리고 생물교란 등에 의해 수층으로 다시 용출될 수 있다. 수층에서 퇴적물로 침전되고, 퇴적물에서 수층으로 재용출되고, 수층에 계속 머무르는 등 하천에서 다양한 형태로 존재하는 유기물 중 용존 유기물(Dissolved Organic Matters, DOM)은 0.7 μm의 여과지를 이용하여 여과하였을 때 여과지를 통과하는 성분을 말한다[1]. 용존 유기물은 크기는 작지만 분자량이 100~100,000 Da으로 넓은 범위를 가지며, 생성 기원에 따라 내부생성과 외부생성으로 구분할 수 있다. 내부생성 유기물은 미생물에 의해 생성되고, 외부생성 유기물은 육상기원 물질로 난분해성 유기물을 다량 포함하고 있다[2]. 난분해성 유기물의 대표적인 물질인 휴믹 성분은 용존 유기물의 40~70% 정도를 차지하고 있는 것으로 알려져 있다[3,4].
용존 유기물은 하천에서 유기 탄소의 주요 저장고 중 하나로 종속영양미생물과 상위 영양단계 생물의 에너지원으로서 중요한 역할을 한다[5]. 미생물과 조류 등의 에너지원으로 사용되어 이산화탄소와 메탄의 형태로 대기 중에 배출되는 과정을 거치면서 용존 유기물은 수체의 탄소 순환에 중요한 영향을 미치게 되므로[6,7], 수체의 탄소 순환을 이해하고 변화를 예측하기 위해서는 용존 유기물의 농도와 성상 변화를 파악하고 용존 유기물이 수체에 미치는 영향에 대해 분석할 필요가 있다.
특히 정체성 수역에서는 상대적으로 퇴적되는 영양염류의 양이 많고, 저층 퇴적물로부터 수층으로 용출되는 용존 유기물이 많다고 알려져 있다. 수층으로 용출되는 용존 유기물의 양이 많기 때문에 정체수역에서는 다른 수역보다 퇴적물이 수질변화에 미치는 영향이 크다고 할 수 있다[8]. 따라서 하천에서 상대적으로 유속이 느린 부분인 보 상류의 지역 퇴적물에서 용출되는 용존 유기물이 수층에 미치는 영향을 살펴보는 것이 보 상류 지역의 수질오염을 제어하는데 중요한 역할을 할 것이라 판단된다.
용존 유기물을 정량화 하는 방법으로 형광분석이 최근에 많이 사용되고 있다[6]. 형광분석은 여기파장과 방출파장을 이용해 용존 유기물의 성분을 분석하는 것으로 두 파장을 적절히 조절하여 유기물질의 기원을 추정하고 오염원을 추적하는 연구에 사용할 수 있다[9,10]. 형광분석은 기존에 용존 유기물을 정량화하기 위해 분자량, 원소분석, 탄소구조 분석을 측정하던 방법과 다르게 전처리 과정이 복잡하지 않으며, 측정 방법이 간단하고, 다양한 성분을 확인할 수 있는데다가 적은 양의 시료로도 측정이 가능하다는 장점을 가지고 있다[11].
본 연구에서는 영산강 죽산보 상류의 퇴적물을 대상으로 퇴적물에서 수층으로 용출되는 용존 유기물에 대해 형광분석을 실시하였다. 이를 통해 용존 유기물의 특성과 퇴적물에서 수층으로 용출되는 유기물이 수층의 탄소 순환 및 수체에 미치는 가능성에 대해 분석하였다.
2. 연구방법
2.1. 연구대상지역
본 연구는 영산강의 죽산보 상류 퇴적물을 대상으로 진행하였다. 시료의 채취는 죽산보 상류 0.5 km와 1.5 km에서 이루어졌으며, 각각 YS1 지점과 YS2 지점으로 표기하였다(Fig. 1, Table 1). 2015년 7월 6일에 각각의 지점에서 퇴적물 시료와 저층수를 채취하였다. 퇴적물 시료는 지름 4 cm, 높이 35 cm의 아크릴 코어를 이용해 채취한 후 공기와 접촉하지 않게 밀봉하였고, 저층수는 니스킨 채수기를 이용해 채수병에 담은 후 아이스박스에 넣어 실험실로 운반하였다.
2.2. 실험방법
채취한 시료를 이용해 각 지점 퇴적물의 유기물 용출 특성을 평가하기 위해 배양실험을 진행하였다. 퇴적물 깊이별로 포함된 유기물의 함량이 다르므로 이에 따른 영향을 고려하기 위해 퇴적물 시료 상층부터 5 cm 높이로 나눈 후 T (Top, 0-5 cm), M (Middle, 5-10 cm), B (Bottom, 10-15 cm)로 분류하여 실험하였다[12]. YS1 지점 퇴적물 저층의 용존산소 농도가 0.8 mg/L로 매우 낮았기 때문에, 퇴적물이 공기 중에 노출되지 않게 질소가 충진된 glove bag에서 깊이별로 분류하였다. 분류한 퇴적물 45 g은 100 ml vial에 담고, 그 위에 유리섬유여과지(GF/C)로 여과한 뒤 질소가스를 이용해 산소를 제거한 저층수 70 mL를 넣었다. Vial은 수 시료의 증발을 막고 내부를 혐기성 상태로 유지하기 위해 고무마개로 밀봉하여, 20℃의 인큐베이터에서 7일 동안 배양하였다. 배양초기, 배양 3일, 7일 후에 시료의 분석을 진행하여 시간에 따른 유기물 용출 특성을 살펴보았다[13,14].
배양한 시료의 상등액을 유리섬유여과지로 여과한 뒤 용존 유기탄소(Dissolved Organic Carbon, DOC)와 형광분석을 실시하였다. 용존 유기탄소는 TOC analyzer (TOC-L, Shimadzu, Japan)을 사용하였고, 형광분석은 Hitachi사의 F-7000을 이용해 3차원 형광 EEMs (Excitation Emission Matrices)을 측정하였다. 형광분석을 위한 스캔 파장범위는 여기파장(Excitation) 200-400 nm, 방출파장(Emission) 290-540 nm로 설정하였으며, scan speed는 2400 nm/min으로 하고 slit은 5 nm로 하였다. 형광분석 시 UV-vis 분광광도계(Libra S32 PC, Biochrom)를 사용해 측정한 시료의 254 nm 흡광도가 0.05 이상일 경우 3차 증류수를 이용해 시료를 희석 한 뒤 분석하였다. 형광분석 데이터를 이용해 Specific ultraviolet absorbance (SUVA), Humification index (HIX), Biological index (BIX), Fluorescence index (FI)를 계산하였다. SUVA는 용존 유기물 중 방향족 유기탄소화합물의 함량을 나타내는 지표로 254 nm 파장에서의 흡광도를 DOC 농도로 나누어주어 구하였다. HIX는 미생물에 의한 부식화(Humification) 정도를 추정하는 지표이며 여기파장 245 nm에서 방출파장 435-480 nm와 300-435 nm의 intensity 비율을 이용해 구하였다[15]. 토착생물의 활성정도를 평가하는 지표인 BIX는 여기파장 310 nm에서 방출파장 380 nm와 430 nm의 intensity 비율을 이용해 계산하였다[16]. FI는 유기물의 기원을 추정하는 지표이며, 여기파장 370 nm에서 방출파장 450 nm와 500 nm의 intensity의 비율을 이용해 구하였다[2].
형광분석 EEMs와 자외선흡광도 결과를 토대로 PARAFAC (Parallel factor data analysis) 모델링 기법을 사용하였고, 모델 식은 식 (1)과 같다.
Xijk는 Emission wavelength j와 Excitation wavelength k에서 측정한 I번째 시료의 형광강도를 의미한다. 모델의 결과로 a, b, c 값을 얻으며 aif는 i번째 시료에 f번째 형광의 농도와 직접적으로 비례하며 bif와 ckf는 각각 f번째 형광의 Emission과 Excitation spectra로 계산된다. F는 구성성분의 숫자를 대표하고, ∈ijk는 잔류요소와 모델에 의해 추정되지 않는 나머지 것들을 대표한다[17]. Component는 Core consistency, 잔차분, 스펙트럼의 모양을 확인을 통해 선택하였으며, PARAFAC에 의해 추출된 component는 유기물이 나타내는 형광물질의 peak을 바탕으로 타 연구에서 제시한 peak와 비교를 통해 진단하였다[18,19].
3. 결과 및 고찰
3.1. 샘플링 지점의 특성
샘플을 채취한 YS1 지점과 YS2 지점은 영산강 죽산보 상류에 위치해 있으며, 수층 깊이는 각각 4.6 m, 4.7 m이었다. 수층과 퇴적물의 특성은 Table 2에 제시하였다. 샘플링 당시 표층의 수온은 YS1 지점에서 25.2℃, YS2 지점에서 25.3 ℃이었으며, 저층 수온은 표층보다 각각 1.0℃, 1.4℃ 낮았다. YS1 지점의 pH는 표층에서 8.8, 저층에서 7.6이었으며, YS2 지점에서는 표층에서 8.5, 저층에서 7.3이었다. 두 지점의 표층 용존산소 농도는 12.3 mg/L, 13.5 mg/L로 과포화 상태였다. 하지만 저층에서는 YS1 지점과 YS2 지점의 용존산소 농도가 0.8 mg/L와 4.2 mg/L로 표층에 비해 현저히 낮았다. 특히 YS1 지점에서는 죽산보로 인해 저층의 순환이 활발하지 못했기 때문에 용존산소 농도가 매우 낮은 것으로 판단된다.
퇴적물의 특성을 살펴보면 YS1 지점에서는 모래의 함량이 3.24%, 실트가 55.42%, 점토가 41.30%이었으며, YS2 지점에서는 모래, 실트, 점토 함량이 각각 55.37%, 33.84%, 10.69%이었다. 각 지점의 모래, 실트, 점토의 함량을 이용하여 입도를 분석하면, YS1 지점의 퇴적물은 Silty clay이고 YS2 지점은 Sandy loam으로 나타났다. 퇴적물 입도 측정 결과 보에서 상대적으로 가까운 YS1 지점이 YS2 지점에 비해 상대적으로 고운 입자를 가지는 것으로 나타났다. 수자원공사가 제공하는 죽산보의 수문자료에 따르면 시료채취일 이전 30일 평균 강우량은 3.15 mm/d이고, 가동보 방류량은 없었다. 따라서 상대적으로 유속이 빠른 만곡부 지점인 YS2에서 쓸려 내려온 고운 입자들이 보에 의해 쓸려 내려가지 않고 YS1 지점에 쌓인 것으로 추정된다.
퇴적물 유기물 함량 분석 결과 총질소와 총탄소는 YS1 지점보다 YS2 지점에서 더 많았다. YS2 지점은 YS1 지점보다 상류에 위치하고 있으며, 유입하천과 가까운 지점에 위치하고 있기 때문에 외부로부터 지속적으로 오염물질이 유입되는 것으로 추정된다[20]. C/N 비는 유기탄소 기원을 추정하는 지표 역할을 하며, C/N 비가 6~9이면 식물플랑크톤 기원 유기물이고 12 이상이면 육상기원 유기물임을 나타낸다. YS1 지점의 C/N 비는 8.66이고 YS2 지점에서는 11.99로 YS1 지점의 유기물은 식물플랑크톤 기원의 유기물이 주로 포함되어 있고, YS2 지점의 유기물은 식물플랑크톤과 육상기원 유기물을 모두 포함하고 있는 것으로 판단된다[21,22].
3.2. DOC
영산강 죽산보의 퇴적물이 담긴 vial을 20℃ 인큐베이터에서 배양한 뒤 상등액의 DOC를 측정하였다(Fig. 2). 배양 초기의 DOC 농도는 보에서 상대적으로 먼 YS2 지점에서 6.27 ppm으로 YS1 지점(4.76 ppm)보다 높았다. 배양 3일 이후 퇴적물 깊이별 수층의 DOC 농도는 YS1 지점에서 초기에 비해 증가하는 경향을 보였으며, Bottom 퇴적물에서는 배양할수록 DOC 농도가 증가하였다. YS2 지점에서는 3일과 7일 후 DOC농도가 초기에 비해 줄어들었으며, Top과 Middle 퇴적물과 배양한 수층의 DOC 농도 변화가 크게 나타났다. YS2 지점 퇴적물의 유기물 함량이 YS1 지점보다 많았지만, YS1 지점에서는 배양기간에 따라 수층의 DOC 농도가 증가하였고 YS2 지점에서는 감소하는 경향을 보였다. 퇴적물에서 용출되는 DOC는 입자가 작을수록 증가하는 경향을 보이기 때문에 YS2 지점보다 입자의 크기가 작은 YS1 지점에서 상대적으로 큰 용출이 발생했다고 판단된다[23~25]. 또, 수층에 있던 유기물질이 시간에 따라 퇴적물층으로 침전되어 DOC 농도에 영향을 미칠 수 있다. 따라서 YS1 지점에서는 침전되는 유기물 양보다 퇴적물에서 용출되는 유기물의 양이 많았기 때문에 배양 3일 이후 DOC의 농도가 증가하고, YS2 지점에서는 침전되는 유기물의 양이 더 많았기 때문에 DOC 농도가 감소하였을 것이라 판단된다. YS2 지점의 Bottom 퇴적물에서는 Top과 Middle 퇴적물과는 다르게 퇴적물에서 용출되는 DOC의 양이 많아 시간에 따른 DOC 농도의 변화가 크지 않았을 것이라 추정된다[26,27]. 배양 기간이 증가하면서 깊이별 DOC의 편차가 감소하였지만, 깊이별 패턴은 지점별로 상이하였다.
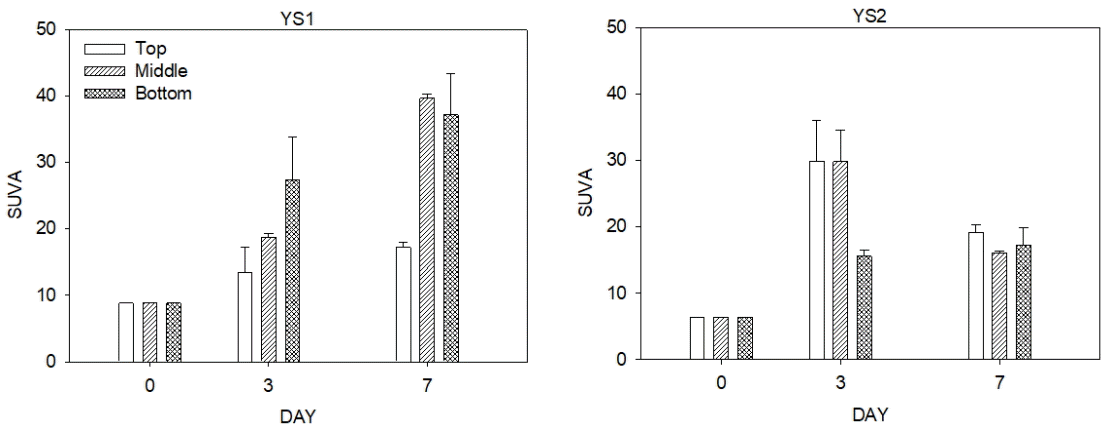
3.3. SUVA, HIX, BIX, FI
배양한 퇴적물의 상등액을 대상으로 측정한 254 nm의 흡광도와 DOC 농도를 이용해 SUVA를 계산하였다(Fig. 3). SUVA는 용존 유기물 중 방향족 유기탄소화합물의 함량을 나타내는 지표로, SUVA값이 2 이상이면 친수성 유기물질과 저분자량 유기물질이 많음을 의미하고, SUVA값이 4 이상이면 소수성 유기물질과 고분자량 휴믹물질을 주로 포함하고 있음을 뜻한다[28]. 본 연구에서 SUVA는 배양초기 YS1 지점에서 8.85, YS2 지점에서 6.43의 값을 보였고, 상대적으로 보와 가까운 YS1 지점에서 SUVA 값이 크게 나타났다. 두 지점 모두 SUVA가 4 이상으로 소수성 유기물질과 고분자량 휴믹물질이 많이 포함되어있음을 알 수 있다. 배양 기간에 따른 SUVA를 살펴보면 배양 3일 후 SUVA의 값이 증가하였으며, YS1 지점에서는 배양 7일까지 지속적으로 증가하였다. 이를 통해 배양 시간에 따라 퇴적물의 미생물 분해 작용이 활발해져 수층의 고분자량의 휴믹물질이 증가하는 것이라 추정해 볼 수 있다. 깊이별로 살펴보면 Middle 퇴적물에서 배양기간에 따른 SUVA의 변화가 크게 나타났다.
HIX는 Fig. 4(a)에 표기하였으며, HIX가 10보다 작으면 미생물에 의한 부식이 비교적 이루어지지 않은 용존 유기탄소가 포함되어있음을 의미하고 HIX값이 낮을수록 산소를 포함하는 작용기 그룹(Oxygen-containing functional group)이 많이 포함되어있다[29,30]. 또한, HIX는 미생물에 의한 부식정도가 늘어날수록 증가한다. 영산강 YS1 지점의 초기 HIX는 1.96, YS2 지점은 2.55로 나타났으며 이는 10보다 작은 값으로, 미생물에 의한 부식이 비교적 적다고 할 수 있다. YS1과 YS2 지점 모두 배양시간에 따라 HIX가 증가하였다. 배양 3일 후 HIX 증가율이 가장 컸으며, YS2 지점 TOP 퇴적물에서는 3일에서 7일 사이의 증가율이 더 크게 나타났다.
형광분석을 이용해 유기물의 특성을 판단할 수 있는 또 다른 지표로 BIX가 있다. 토착생물의 활성을 평가하는 지표인 BIX는 Fig. 4(b)에 제시하였다. BIX가 0.6보다 작은 값을 가지면 육상에서 기인한 용존 유기물에 가깝고, 1보다 큰 값을 가지면 미생물에서 기인한 용존 유기물과 상응한다[16]. 분석결과 배양 초기의 BIX는 YS1지점과 YS2 지점에서 각각 1.34와 0.92로 나타났으며, 보에서 상대적으로 가까운 YS1 지점에서 높은 값을 보였다. YS2 지점에서는 0.6과 1 사이의 값을 가져 육상과 미생물 복합 기원 용존 유기물의 특성을 가지는 것으로 판단된다. BIX 값은 퇴적물 배양에 따라 감소하는 경향을 보였으며, YS1 지점과 YS2 지점 모두 배양에 의해 용출되는 용존 유기물은 복합기원 유기물의 특성을 갖는 것으로 나타났다. 퇴적물 깊이별 경향성을 살펴보면 3일 후까지는 모든 깊이에서 비슷한 경향을 보였으며, 7일 후에는 일정한 경향성을 보이지 않았다.
유기물의 기원을 추정하는 지표인 FI는 Fig. 4(c)에 나타냈다. FI가 1.4보다 작을 때 육상기원 유기물과 방향족 유기탄소를 많이 포함하고 있으며, 1.9보다 클 때 미생물기원 유기물질을 포함하고 있으며 방향족 유기탄소의 함량은 적음을 의미한다[2]. 배양 초기 YS2 지점의 수층의 FI는 1.4보다 작은 값을 가져 육상과 미생물의 복합기원 용존 유기물이 포함되어있는 것으로 나타났다. 퇴적물을 배양하였을 때 수층의 용존 유기물은 YS1 지점과 YS2 지점 모두 복합기원으로 추정되며, 이는 BIX 분석 결과와 일치한다.
실험 초기의 YS1과 YS2 지점 퇴적물의 용존 유기탄소, 총질소 그리고 총탄소의 양은 YS2 지점에서 더 많았다. 하지만 용존 유기물 중 소수성 유기물과 고분자 유기물은 YS1 지점에서 상대적으로 많이 포함되어있었다. 퇴적물에 포함된 소수성 유기물과 고분자 유기물은 배양시간에 따라 수층으로 용출되었으며, 배양에 의해 YS1 지점과 YS2 지점 퇴적물에서 용출되는 유기물은 육상 기원과 미생물 기원 유기물이 모두 포함된 복합 기원 유기물로 추정된다.
3.4. PARAFAC
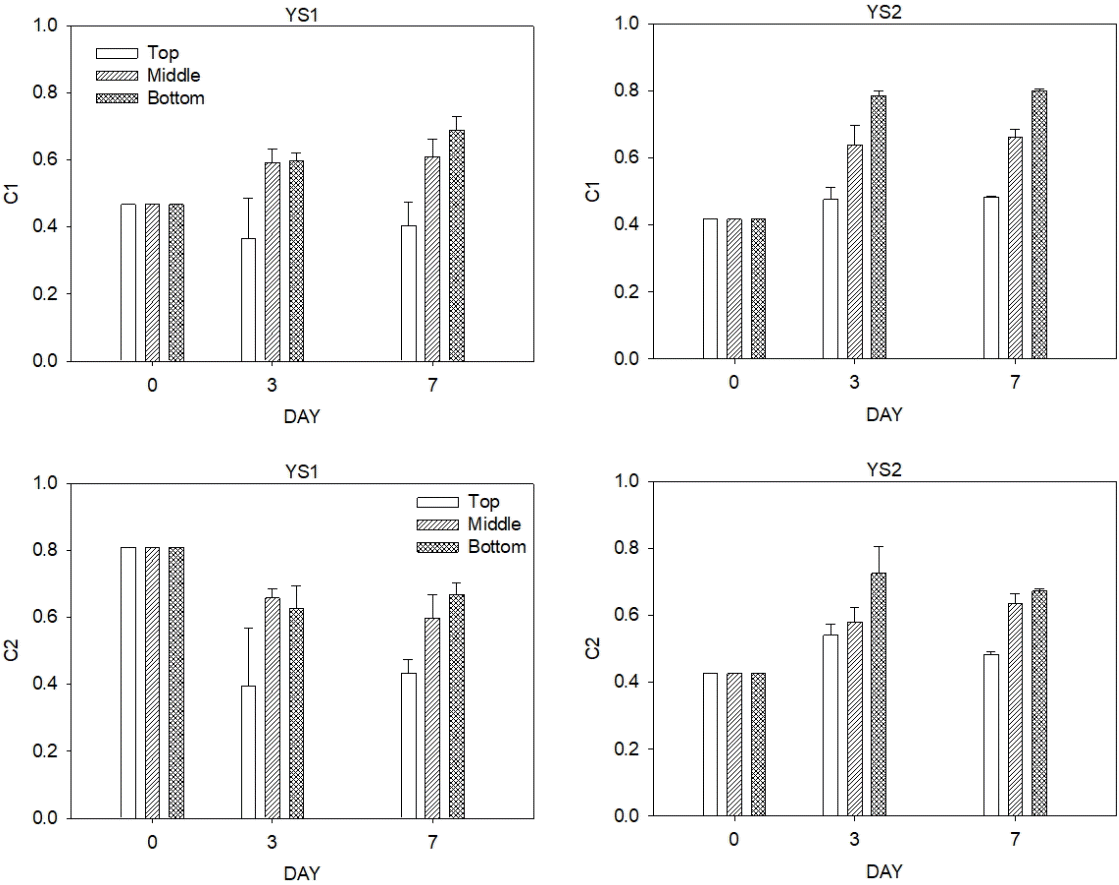
영산강 YS1, YS2 지점의 EEMs를 대상으로 PARAFAC 분석을 한 결과 영산강에서는 두 개의 성분(Component)을 이용한 모델이 통계적으로 가장 좋은 결과를 제공하며 EEMs를 99.9% 이상 설명할 수 있다. 분석 결과 얻은 영산강의 성분을 Fig. 5와 Table 3에 표기하였다. 기존의 연구에서 보고된 성분의 Excitation 및 Emission 위치 특성을 토대로 배양시료의 형광성분을 확인하였고, 두 개의 형광성분을 각각 C1과 C2로 명명하였다. C1은 Excitation 250 nm 이하와 330 nm, Emission 440 nm에서 피크가 최대로 나타났으며, Coble [31]의 연구에 제시된 C와 Stedmon and Markager [32] 연구의 C6과 유사한 피크를 보였다. Coble [31]에 따르면, 본 연구의 C1은 육상기원의 Humic-like 물질이며 여러 자연수체에서 발견되는 피크이다. C2는 Excitation 250 nm 이하와 280 nm, Emission 370 nm에서 피크가 최대로 나타났다. 선행연구[32,33]에 따르면 본 연구의 C2는 Tryptophan-like 물질이며 숲지대 육상기원 형광물질 혹은 식물성 플랑크톤 군집과 조류에서 기인한 유기물이라 할 수 있으며, 표층수의 생물학적 생산에 영향을 미치는 물질이다[31,34].
EEMs의 결과 얻어진 구성성분 C1, C2의 intensity를 Fig 6에 나타냈다. Humic-like 물질인 C1의 intensity는 배양 초기 YS1 지점에서 YS2 지점보다 높게 나타났다. 고분자 휴믹물질의 지표인 SUVA 역시 YS1 지점이 YS2 지점보다 높았는데, 그것과 일치하는 결과이다. YS1의 Middle과 Bottom 퇴적물 그리고 YS2 지점에서는 배양 시간에 따라 Humiclike 물질의 intensity가 증가하는 경향을 보였다. YS1의 표층 퇴적물의 경우 배양 3일 후 C1의 intensity가 감소하였다. 퇴적물 깊이별 특징을 살펴보면 표층 퇴적물의 변화가 가장 적었으며 저층 퇴적물의 변화가 가장 컸다. Humic-like 물질은 SUVA 값이 클수록 결합력이 증가한다고 알려져 있기 때문에 배양기간 동안 SUVA 값의 증가가 컸던 YS1 지점 Middle과 Bottom 퇴적물의 3일과 7일 후의 C1의 intensity 변화가 적었고, SUVA 값의 증가가 크지 않았던 YS2 지점의 Bottom 퇴적물의 3일 후의 C1 intensity 변화가 크게 나타난 것으로 보인다[35]. C2는 Tryptophan-like 물질로 초기 intensity는 상대적으로 보에서 가까운 YS1 지점이 YS2 지점보다 높게 나타났다. YS1 지점에서는 Tryptophan-like의 intensity가 배양 3일 후 감소하는 경향을 보였으며 표층 퇴적물에서 가장 큰 감소를 보였다. YS2 지점에서는 배양 3일 후 증가하였다가 7일 후 감소하는 경향을 보였다. 배양 3일 후에는 저층 퇴적물에서 가장 큰 증가를 보였다. 실험 결과를 통해 퇴적물을 배양할 때, YS1 지점에서는 Humic-like 물질이 용출되고, YS2 지점에서는 Humic-like와 육상기원 Tryptophan-like물질이 모두 용출됨을 알 수 있다.
4. 결 론
본 연구에서는 영산강 죽산보 상류 퇴적물을 대상으로 수층으로 용출되는 용존 유기물을 형광분석을 통해 측정하였다.
1) 시료 채취 당시 영산강 죽산보 YS1 지점과 YS2 지점의 깊이는 각각 4.6, 4.7 m이었으며, 수온은 24.2-25.2, 23.9-25.3℃, pH는 7.6-8.8, 7.3-8.5, 용존산소 농도는 0.8-12.3, 4.2-13.5 mg/L이었다. 두 지점의 저층 용존산소 농도는 유의한 차이를 보였다.
2) YS1 지점의 퇴적물은 Silty clay이고, YS2 지점은 Sandy loam으로 보에서 가까운 YS1 지점의 퇴적물이 YS2 지점 퇴적물에 비해 고운입자를 가지고 있었다. 퇴적물 원소 분석 결과 총질소와 총탄소는 YS1 지점보다 YS2 지점에서 더 많았다.
3) 배양 초기 DOC농도는 YS1 지점보다 YS2 지점에서 높았다. 하지만 배양에 따른 용존 유기탄소는 상대적으로 보에서 가깝고 입자 크기가 작은 YS1 지점에서 증가하는 경향을 보여 퇴적물 입도가 용존 유기탄소 용출에 영향을 준 것으로 판단된다.
4) 형광분석을 이용해 유기물 특성의 지표인 SUVA, HIX, BIX, FI를 계산한 결과, 용존 유기물 중 소수성 유기물과 고분자 유기물은 YS2 지점보다 YS1 지점에 많이 포함되어 있었다. 퇴적물에 포함된 유기물은 배양에 따라 수층으로 용출되었으며, 용출되는 유기물은 육상기원 유기물과 미생물기원 유기물이 혼합된 복합기원 휴믹물질이었다.
5) PARAFAC 분석 결과 첫 번째 주요 성분 C1은 Humiclike 물질, 두 번째 주요 성분 C2는 Tryptophan-like 물질로 나타났다. 퇴적물을 배양실험으로부터 YS1 지점에서는 Humiclike 물질이 용출되고, YS2 지점에서는 Humic-like와 육상기원 Tryptophan-like물질이 모두 용출됨을 알 수 있었다.
6) 분석 결과 퇴적물에 포함된 유기물은 YS2 지점에 많았지만, 상대적으로 보에서 가깝고 입자 크기가 작은 YS1 지점에서 용출되는 용존 유기 탄소가 많았으며, 소수성 유기물과 고분자 유기물도 많이 포함되어 있었다. 이러한 결과로부터 정체성 수역 내 퇴적물의 유기물 용출 특성이 시간적, 공간적으로 변화함을 알 수 있었고, 이는 향후 정체수역 수질관리를 위한 기초자료로 활용될 수 있다고 판단된다.
Acknowledgements
이 논문은 국립환경과학원의 “4대강 보 퇴적물 용출 조사 및 평가”의 일환으로 수행되었으며, 이에 감사를 표합니다.