폐수 내 인 흡착 제거를 위한 제강슬래그와 활성탄 비교
Comparison of Steel Slag and Activated Carbon for Phosphate Removal from Aqueous Solution by Adsorption
Article information
Abstract
본 연구에서는 제강슬래그와 활성탄의 수중의 인 제거 효율을 비교하였다. 제강슬래그는 0.5~2.0 g/200 mL, 활성탄은 3.0~6.0 g/200 mL를 주입하여 흡착실험을 진행하였다. 제강슬래그의 양에 따른 제거 효율은 60분의 실험 결과 47~99%, 활성탄은 240분의 실험 결과 81~98%를 보였다. 흡착등온식을 적용하였을 때 Langmuir식에 더 적합하였으며 제강슬래그와 활성탄의 흡착능력을 비교하였을 때, 이론적 최대흡착량(Q0)은 제강슬래그에서 91 mg/g, 활성탄에서 27 mg/g으로 나타났다. 또한 반응속도는 유사 2차식을 따르며 속도상수(k2)는 제강슬래그에서 0.023~0.136 g/mg.min, 활성탄에서 0.025~0.122 g/mg.min으로 나타났고, 평형에서의 흡착량(qe)은 제강슬래그가 10.8~18.4 mg/g, 활성탄은 3.30~5.49 mg/g로 나타났다. pH의 경우 초기 pH 2에서 제강슬래그와 활성탄 모두 가장 높은 인 제거효율을 나타내었다. 따라서 폐수 내 인 제거 면에서 제강슬래그가 활성탄에 비해 우수하였다.
Trans Abstract
This study investigated the potential use of steel slag (SS) (0.5~2.0 g/200 mL) for the removal of phosphate from wastewater compared with activated carbon (AC) (3.0~6.0 g/200 mL). The adsorption equilibrium data were best represented by Langmuir isotherm and its calculated maximum adsorption capacity was 91 mg/g for SS, 27 mg/g for AC. The adsorption kinetics was found to follow the pseudo-second order kinetics model and its rate constant was 0.0232~0.1357 g/mg·min for SS, 0.0247~0.1221 g/mg·min for AC. The overall uptake for the SS and AC was maximum at pH 2. Therefore, it can be concluded that steel slag could play an effective role in reducing phosphate concentration compared with activated carbon.
1. 서 론
최근 들어 빈번해지고 있는 하천의 녹조발생은 대표적인 부영양화 현상이다. 폐쇄성 수역에 과량의 영양염류(질소, 인 등)가 유입될 경우 조류 등의 수생생물이 증식하여 부영양화가 발생한다. 하천에서의 총인은 평상시에는 점오염원으로부터 지속 배출되다가 비가 내리면 유역 내 비점오염원으로부터 고농도로 유출되어 하천에 대부분 과부하 상태로 존재한다. 또한 온난화와 같은 기후변화 요인까지 가중된다면 부영양화는 더욱 쉽게 발생할 수 있다. 물이 지속적으로 흘러가는 경우, 녹조가 발생되어도 증식 속도가 제한적이기 때문에 녹조가 심각해지지 않는 것이 일반적이다. 그러나 국내 많은 하천은 이수 목적으로 댐이나 보 등 다양한 시설물들이 물의 흐름을 차단하고 있어서 부영양화에 취약하다[1].
기존의 인 제거방법으로는 화학적 침전 처리법, 생물학적 처리법이 있으나 화학적 침전 처리법의 경우 높은 제거율과 안정성을 보이지만 고가의 처리비용과 과량의 슬러지를 발생시키며, 생물학적 처리법은 처리환경 및 조건에 민감하여 안정적인 인 제거율을 확보하기 어려운 단점이 있다[2]. 유기물의 경우 활성탄의 처리 수준이 화학적인 방법에 비하여도 큰 차이가 없을 뿐 아니라 사용된 활성탄을 재생하여 다시 사용할 수 있다[3].
활성탄은 대기, 정수, 폐수처리 등 광범위하게 사용되는 매우 효과적인 흡착제이며[4] 다공질 구조의 탄소물질로서 내부 표면이 매우 크고 표면이 소수성이기 때문에 여러 가지 종류의 난분해성 유기물질, 인 및 색도 등을 흡착제거할 수 있는 흡착제이다. 또한 입자 크기에 따라 분말과 입상으로 분류되며 분말 활성탄을 쓰는 경우 입상 활성탄보다 적은 양으로 더 잘 흡착시킬 수 있다. 제강슬래그는 활성탄과 같이 다공성의 특성과 넓은 비표면적으로 인하여 부유물질과 오염물질을 흡착제거가 가능하며[5], 주성분은 CaO로 수중의 인을 정석반응을 통해 제거할 수 있다. 국내 제철소에서 발생하는 제강슬래그는 연간 약 660만 톤이며[6], 시멘트 원료, 비료 원료, 도로용 골재, 토목용 골재 등으로 재활용이 되고 있다. 제강슬래그를 인 제거에 활용할 경우 자원의 재활용 측면에서 매우 효과적일 것이다.
따라서 본 연구에서는 제강슬래그와 활성탄을 비교하여 제강슬래그의 인 흡착 가능성을 알아보고자 하였다. 이를 위해 Langmuir 및 Freundlich 흡착등온식, 1차 및 2차 속도식 등을 이용하여 인 제거효율을 정량적으로 비교, 분석하였다.
2. 연구방법
2.1. 실험 재료
본 실험에서 사용한 흡착질은 KH2PO4(대정화금, 대한민국)를 사용하였고, 흡착제로 국내 ‘ㄱ’사의 제강슬래그와 네덜란드 ‘Norit’사의 분말활성탄(모델명: Hydrodarco)을 사용하였다. 제강슬래그는 실험에 사용하기 전에 볼밀(명보요업기계, 대한민국)을 이용하여 분쇄한 후, 표준체를 이용하여 입자크기를 측정하였다. 사용된 흡착제의 입자크기는 제강슬래그가 0.125~0.15 mm (100~120 mesh), 활성탄이 0.045 mm (325 mesh)이며 제강슬래그의 주성분(‘ㄱ’사 자료)은 CaO 39.5 wt%, total Fe 21.12 wt%, SiO2 10.5 wt% 등으로 나타났다(Table 1).
2.2. 실험 방법
증류수에 KH2PO4를 첨가하여 합성폐수(100 mg P/L)를 제조하여 실험에 사용하였다. 합성폐수 200 mL를 삼각플라스크 250 mL에 넣고, 제강슬래그 0.5~2.0 g/200 mL, 분말활성탄 3.0~6.0 g/200 mL을 주입하여 흡착실험을 수행하였다. 반응시간은 제강슬래그의 경우 흡착제 투입 후, 10분까지는 2분 간격으로, 10분부터 60분까지는 10분 간격으로 시료를 채취하였고, 활성탄의 경우 흡착제 투입 후, 60분까지는 10분 간격으로, 60분부터 240분까지는 60분 간격으로 시료를 채취하였다. 초기 pH에 따른 인 제거 효율을 확인하기 위해서 슬래그 투입 전에 pH를 2, 4, 6, 8로 변화시켜 제강슬래그의 경우 반응시간 60분, 활성탄의 경우 반응시간 240분에서 흡착실험을 진행하였으며, pH를 조절하기 위해서 0.1 N HCl와 0.1 N NaOH를 사용하였다. 흡착 실험 진행 시 진탕배양기((주)비전과학, VS-8480 SF, 대한민국)를 25℃, 200 rpm 조건에서 운전하였다. 채취한 시료를 진공여과펌프를 이용하여 GF/C (0.45 μm) 필터로 여과 후 시료를 Standard Method의 Ascorbic Acid Method를 사용하여 인을 측정하였다[7]. 주사전자현미경(scanning electron microscope, SEM)/에너지 분산형 X선 분광기(energy dispersive X-ray spectroscopy, EDS) (Hitachi, S-4800, 일본)를 이용하여 합성폐수(100 mg P/L)에 슬래그 2.0 g/200 mL를 넣어 60분 교반을 진행한 시료와 인을 흡착하지 않은 시료의 표면 구성물질을 정성적으로 측정하였다.
3. 결과 및 고찰
3.1. 흡착제 주입량에 따른 인 제거 효율
3.1.1. 제강 슬래그
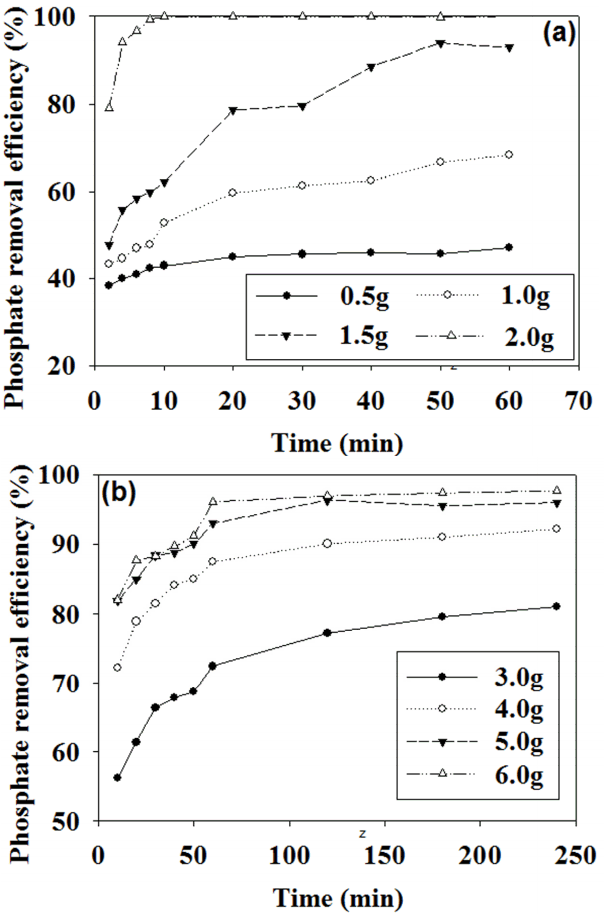
제강슬래그 양(0.5~2.0 g/200 mL)을 달리하여 시간에 따른 인 제거효율을 살펴보면, 주입량 2.0 g, 반응시간 10분에서 인 제거율 99%로 인 제거 속도 및 제거효율 면에서 가장 좋았다. 반응시간 60분의 경우, 제강슬래그 주입량 0.5 g에서 42%, 1.0 g에서 68%, 1.5 g에서 93%의 인 제거율을 보였다(Fig. 1(a)). 한 선행연구[8]의 경우, 회분식 실험에서 인 농도 11.40 mg P/L, 슬래그 주입량 2 g/50 mL, 교반조건 120분, 200 rpm (25℃) 조건으로 인 농도를 제외하면 유사한 실험조건이지만 인 제거율이 76%정도로 비교적 낮은 효율을 나타내었다. 가장 높은 흡착제 주입량기준으로 선행연구의 질량당 제거효율이 0.22 mg P/g slag, 본 연구에서 슬래그는 9.9 mg P/g slag로 본 연구에서의 질량당 제거효율이 45배 높았다. 선행연구에서 슬래그의 입자 크기는 1~2 mm이며 본 실험에 사용한 슬래그의 입자 크기는 0.12~0.15 mm로 약 7배 이상의 차이를 보여 제강슬래그 입경이 작을수록 높은 효율을 보여줌을 알 수 있다.
3.1.2. 활성탄
활성탄 양(3.0~6.0 g/200 mL)을 달리하여 시간에 따른 인 제거효율을 살펴보면, 활성탄의 경우 주입량 6.0 g, 반응시간 60분에서 인 제거율 96%로 가장 빠른 시간에 높은 제거율을 보였다. 반응시간 240분의 경우, 활성탄 주입량 3.0 g에서 81%, 4.0 g에서 91%, 5.0 g에서 96%의 인 제거율을 보였다(Fig. 1(b)). 가장 높은 흡착제 주입량 기준으로 질량당 제거효율이 제강슬래그가 9.9 mg P/g, 활성탄이 3.2 mg P/g로 제강슬래그의 경우 3배 높게 나타났다. 활성탄의 경우 입경이 0.045 mm로 제강슬래그(0.125~0.15 mm)에 비해 입자크기가 작고 반응시간도 240분으로 제강슬래그(60분)에 비해 4배가량 길었음에도 질량당 제거효율이 더 낮은 것으로 보아 제강슬래그의 인 제거 능력이 활성탄에 비해 우수함을 알 수 있었다.
3.2. 흡착등온식
흡착등온식이란 일정 온도에서 흡착 평형이 이루어졌을 때 어떤 물질의 흡착량과 그 농도와의 관계를 나타내는 식이다. 흡착제의 성능은 흡착등온식 인자들의 비교를 통해 알 수 있으며, 기존 선행연구[2,9,10]와 같이 Freundlich와 Langmuir 흡착등온식을 적용하여 제강슬래그와 활성탄의 흡착성능을 비교하였다. 흡착량은 흡착실험이 완료된 후 용액 중에 잔류하는 흡착질의 농도를 측정하고 식 1을 이용하여 구하였으며, Freundlich와 Langmuir 흡착등온식에 적용하였다.
여기서,
qe : 흡착평형 상태에서 흡착제 단위 g당 흡착된 흡착질의 양(mg/g)
C0 : 흡착질의 초기 농도(mg/L)
Ce : 흡착평형 후 용액 중의 흡착질 평형 농도(mg/L)
V : 용액의 부피(L)
W : 흡착제 투여량(g)
3.2.1. Freundlich 흡착등온식
Freundlich 흡착등온식은 Langmuir 흡착등온식에 흡착열이 표면 덮임의 정도에 따라 지수적으로 감소된다는 내용을 도입하여 유도된 식으로 흡착제에 흡착되는 흡착제의 양과 용액의 농도의 관계는 qe = KF Ce1/n로 정의되며 양변에 로그를 취하여 1차식으로 변형할 수 있다[11].
여기서, qe는 흡착제 단위 중량당 흡착된 흡착질의 양(mg/g), Ce는 용액중의 평형 농도(mg/L)를 의미한다. KF는 흡착제의 흡착능(mg/g)에 대한 척도로서 크면 클수록 흡착능이 양호함을 의미하며, n은 흡착동력의 크기를 나타낸다. 직선식은 Fig. 2(a)에 나타내었으며 KF의 경우 제강슬래그 58.9 mg/g, 활성탄 13.9 mg/g로 제강슬래그가 약 4.2배 높았다. n의 경우도 제강슬래그 14.1, 활성탄 4.27로 제강슬래그가 약 3.3배 높았다(Table 2). 선행연구[8]에서는 입경 2 mm에서 KF가 0.088 mg/g, n이 1.117로 많은 차이를 보였는데 이는 인 흡착성능이 입자크기가 작을수록 우수하기 때문인 것으로 판단할 수 있다.
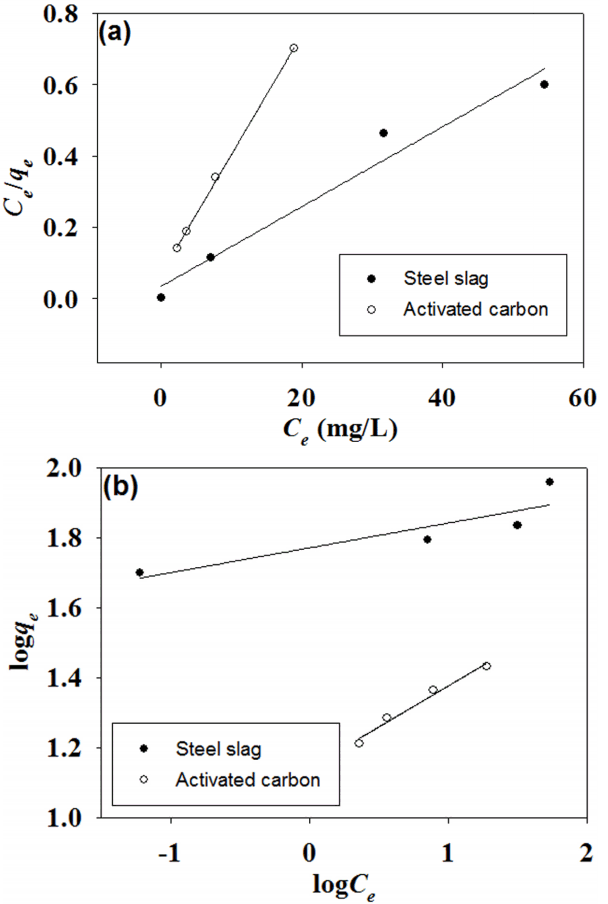
Freundlich (a) and Langmuir (b) isotherms for phosphate adsorption with the steel slag and activated carbon.
3.2.1. Langmuir 흡착등온식
Langmuir 흡착등온식[12]은 단분자층의 두께로 흡착의 결합력이 작용하는 것으로 보고 그 이상 분리된 층에서는 흡착이 일어나지 않는다는 모델을 이용하여 도입된 식으로 Langmuir 흡착은 단분자층 흡착이다[11].
여기서, Q0는 흡착제의 최대 흡착량(mg/g), KL는 Langmuir 상수, Ce는 평형에서의 흡착농도(mg/L)를 나타낸다. 직선식은 Fig. 2(b)에 나타내었다. R2(결정계수)는 회귀직선식의 적합도를 나타내는 척도로, 1에 가까울수록 수치가 모델에 적합하다는 것을 나타낸다. Freundlich와 Langmuir 흡착등온식을 적용하였기 때문에 R2를 비교하여 제강슬래그와 활성탄의 인 제거 특성이 어떤 모델에 더 적합한지 확인하였다. Freundlich식에서의 R2값은 0.779~0.979를 나타내었고, Langmuir식에서는 0.964~0.999을 나타내어 Langmuir 흡착등온식 모델이 본 연구의 실험결과를 보다 잘 설명한다고 볼 수 있다. 본 연구에서 제강슬래그의 Q0가 89.3 mg/g인데 반해, 선행연구[9]에서는 Q0가 5.3 mg/g으로 본 연구에서의 흡착제 최대 흡착량이 17배로 높았다. 활성탄의 경우 Q0가 29.8 mg/g을 나타내어 제강슬래그가 약 3배 높았다.
3.3. 흡착속도
제강슬래그와 활성탄의 인 제거 속도를 비교하기 위하여 유사 1차 속도식과 유사 2차 속도식을 적용하여 인자들을 비교, 분석하였다.
3.3.1. 유사 1차 속도식
유사 1차 속도에 대한 방정식은 Lagergren에 의해 문헌에서 처음 도입되었으며 일반적으로 Ho와 McKay에 의해 제안된 형태로 나타낸다[13,14]. 유사 1차 속도식은 식 (4)와 같이 나타낼 수 있으며,
식 (4)를 식 (5)와 같이 직선식으로 나타낼 수 있다.
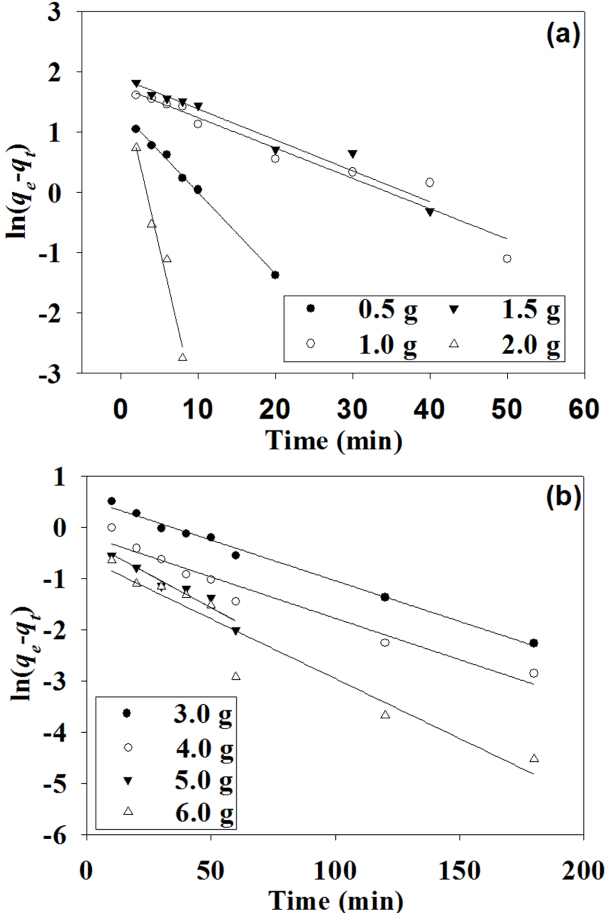
여기서, k1는 유사 1차 속도상수(min-1), qt는 시간 t에서의 흡착량(mg/g), qe는 평형에서의 흡착량(mg/g)을 나타낸다. k1은 제강 슬래그의 경우 0.050~0.553 min-1, 활성탄의 경우 0.016~0.026 min-1을 나타내었으며, qe는 제강슬래그의 경우 3.88~6.68 mg/g, 활성탄의 경우 1.18~1.86 mg/g, R2는 제강슬래그의 경우 0.944~0.997, 활성탄의 경우 0.917~0.991을 나타내었다(Table 3, Fig. 3).

Pseudo-first and pseudo-second order constants and correlation coefficients for phosphate adsorption onto steel slag and activated carbon at various adsorbent doses
3.3.2. 유사 2차 속도식
유사 2차 속도식은 일반적으로 Ho와 McKay에 의해 제안된 형태로 식 (6)과 같이 나타낼 수 있다[13].
식 (6)은 식 (7)과 같이 직선식으로 전환할 수 있다.
k2는 유사 2차 속도상수(g/mg·min)를 나타내며, qt와 qe는 유사 1차식과 동일하다. k2는 제강 슬래그의 경우 0.023~0.136 g/mg·min, 활성탄의 경우 0.025~0.122 g/mg·min을 나타내었다. qe는 제강슬래그의 경우 10.8~18.4 mg/g, 활성탄의 경우 3.30~5.49 mg/g, R2는 제강슬래그의 경우 0.992~0.999, 활성탄의 경우 0.999를 나타내었다(Table 3, Fig. 4). R2값이 유사 1차식 보다 유사 2차식에서 더 높게 나타났으며 이는 제강슬래그와 활성탄으로 인을 제거할 경우 유사 2차식모델에 더 적합하다는 것을 나타낸다. 유사 2차식의 인자인 qe와 k2를 비교하였을 때, k2는 큰 차이를 나타내지 않았지만 qe는 제강슬래그에서 약 3배 우수하였다. 이는 제강슬래그가 활성탄보다 우수한 흡착특성을 갖고 있을 뿐만 아니라 제강슬래그 내 금속이온(Al3+, Ca2+, Mg2+)이 인을 침전시키기도 하기 때문인 것으로 추정된다[15]. 또한 제강슬래그 주입량 2 g에서의 qe는 10.8 mg/g으로 실험값인 9.9 mg/g과 유사한 값을 나타내었다. 마찬가지로 활성탄 주입량 6 g에서의 qe는 3.3 mg/g으로 실험값 3.2 mg/g과 유사하고 이는 R2값과 마찬가지로 유사 2차식에 더 적합하다는 것을 나타낸다.
3.4. 초기 pH에 따른 인 제거 효율
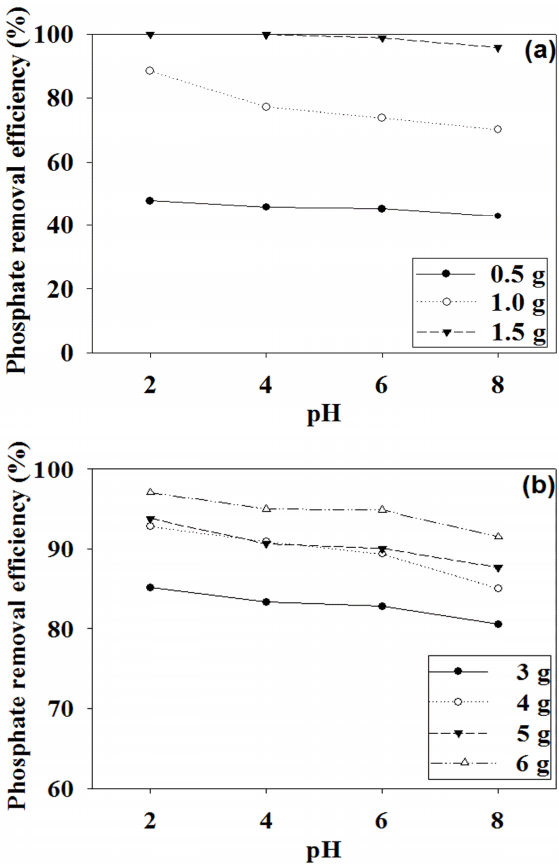
흡착제 종류와 양에 관계없이 인산염의 제거 효율은 초기 pH가 증가함에 따라 조금씩 감소하는 것으로 나타났다(Fig. 5). 제강슬래그는 초기 pH 2에서 인산염의 최종 제거효율은 47% (0.5 g)에서 99% (1.5 g)까지 나타났으며, 점점 감소하여 pH 8에서는 인산염의 최종 제거효율은 42% (0.5 g)에서 95% (1.5 g)까지 감소하였다. 활성탄의 경우도 초기 pH 2에서 인산염의 최종 제거효율은 97% (6 g)에서 85% (3 g)까지 나타났으며, 점점 감소하여 pH 8에서는 인산염의 최종 제거효율은 91% (6 g)에서 80% (3 g)까지 감소하였다. 이는 제강슬래그는 pH가 낮아짐에 따라 표면이 양전하로 하전되어 인산염에 대한 친화성이 증가하고, pH가 높아짐에 따라 흡착제 표면에 더 많은 음전하가 흐르게 되어 인산염과의 반발력이 증가하기 때문인 것으로 추정된다[15]. 반면에 정석반응은 비교적 높은 pH를 요구하기 때문에 본 실험에서 사용된 인 제거 기작은 정석반응보다는 흡착반응에 더 가깝다고 볼 수 있다[16].
3.5. 현미경 분석
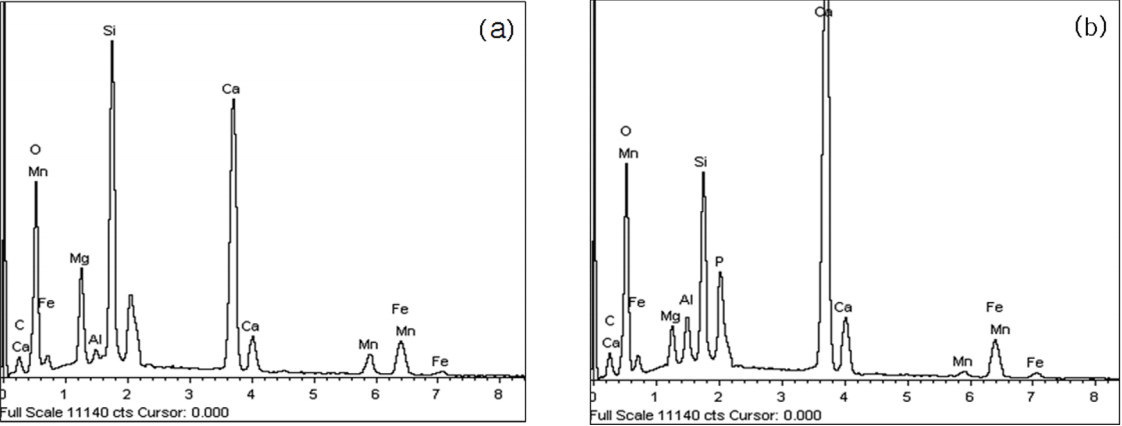
인 제거효율이 99% 이상의 실험조건에서 제강슬래그의 흡착반응 전, 후 입자의 표면을 분석한 결과 반응전의 표면(Fig. 6(a))보다 반응후의 표면(Fig. 6(b))이 거칠어짐을 확인하였다. 제강슬래그를 이용한 인 흡착반응 후 슬래그의 매끈한 표면(Fig. 7(a))에서는 인이 검출되지 않았지만 거친 부분(Fig. 7(b))에서는 인이 검출되었다. 이는 슬래그 표면에 인이 부착되면서 표면이 거칠어진 것으로 추정된다.
4. 결 론
본 연구는 폐수 중에 존재하는 인산염을 제거하기 위하여 제강슬래그와 활성탄을 이용하여 투입 양 변화, 폐수의 초기 pH의 변화에 따른 인산염의 제거특성과 반응속도상수와의 관계를 회분식 실험을 통하여 분석하였다. 활성탄의 경우 질량당 인 제거량이 3.2 mg P/g로 제강슬래그(9.9 mg P/g slag)보다 약 3배 낮은 값을 나타내어 제강슬래그의 인 흡착 성능이 활성탄에 비해 우수하였다. 제강슬래그와 활성탄 모두 Langmuir 흡착등온식과 유사 2차식에 더 적합하였다. 초기 pH의 변화에 따른 인 제거효율을 비교하였을 때 pH 2~8 범위에서 제강슬래그와 활성탄이 초기 pH가 낮아질수록 제거효율이 증가하였다.
Acknowledgements
본 연구는 환경부의 환경정책기반공공기술개발사업에서 지원받았습니다.