1. 서 론
급속한 산업의 발달로 사용되는 유기 화학물질의 종류가 다양해지는 것뿐만 아니라, 이들 화학물질의 사용량도 매년 크게 증가하고 있다. 이에 따른 환경오염 문제도 증가하고 있으며, 특히 산업체에서 방류되는 산업폐수로 인한 수질 오염 문제가 지속적으로 제기되고 있다[1]. 1,4-Dioxane은 최근 수계에서 주목받고 있는 오염물질로서, 염소계 용매의 안정제와 광택제, 코팅제, 접착제 등의 원료인 cellulose acetate, ethyl cellulose, benzyl cellulose를 용해시키는 용매로서 뿐만 아니라[2,3], 화장품, 의약품 제조, 고무화학 등 여러 산업 분야에서 용매로 사용되며[4,5], 폴리에스터(polyester) 및 계면활성제 등의 제조 공정에서 부산물로 생성된다[6,7]. 1,4-Dioxane의 배출량은 매년 증가하고 있으며, 국내에서 2017년 기준으로 연간 약 2.5톤이 산업폐수에 포함되어 방류되었다고 보고되었다[1]. 1,4-Dioxane은 화학적으로 안정한 고리형 에테르 화합물로 물에 쉽게 용해되며, 가연성 화학물질로서 빛에 장기간 노출 시 폭발성의 peroxides를 형성할 수 있다[8]. 토양, 유기물 등에 잘 흡착되지 않기 때문에 인근 하천이나 지하수로 쉽게 유입될 수 있으며, 하천과 지하수 등으로 유입된 1,4-dioxane은 광범위한 지역에서 오염원이 될 수 있다고 알려져 있다[9,10].
국제 암연구기관(International Agency for Research on Cancer)에서는 쥐의 비강암과 간암 및 기니피그의 담낭암의 증가사례를 바탕으로 1,4-dioxane을 인간에서 발암 가능성이 있는 물질인 Group 2B로 분류하고 있다[11]. 1,4-Dioxane은 인간과 동물에서 눈과 호흡기에 질병을 유발하고, 고농도의 1,4-dioxane에 노출 시 단시간에 신장과 간에 심각한 손상을 유발하며, 직업적으로 피부와 점막에 노출되거나 흡입한 사람들에서 신장에 문제를 일으키는 것으로 보고되었다[12].
현재 1,4-dioxane은 대부분 화학적 방법으로 처리되고 있다. 특히 고도산화공정(advanced oxidation process, AOP)은 1,4-dioxane을 비교적 효과적으로 처리하는 것으로 보고되고 있으나, 이러한 공정은 큰 규모의 기반시설이 필요하며, 추가적인 2차 처리와 높은 처리비용 및 2차 오염 등의 문제가 제기되는 것으로 알려져 있다[13-16]. 최근 환경친화적인 방법으로 미생물을 이용한 1,4-dioxane의 제거에 대한 연구가 발표되고 있다. 1,4-Dioxane을 분해할 수 있는 미생물로서, Pseudonocardia sp., Acinetobacter sp., Mycobacterium sp., Flavobacterium sp., Rhodococcus sp., Cordyceps sp. 등이 환경으로부터 분리되었으며[17-23], 이들을 이용한 1,4-dioxane 생분해에 관련된 연구가 보고되었다. 그러나 지금까지 발표된 1,4-dioxane 생분해에 관한 연구는 주로 단일배양을 이용하여, 1,4-dioxane을 분해할 수 있는 미생물 자원의 확보 또는 생화학 및 유전학적 현상을 규명하는 연구에 국한되어 왔다. 일부 연구에서 지하수, 산업 폐수, 토양 등에서 1,4-dioxane을 분해할 수 있는 미생물컨소시엄을 확보하여[24-26], 이들을 1,4-dioxane 제거에 적용하려는 시도를 보고하였다. 미생물컨소시엄에는 1,4-dioxane의 분해에 직접 관여하는 미생물뿐만 아니라, 1,4-dioxane 분해를 개시하거나, 중간대사산물을 분해하여 1,4-dioxane 분해를 보조해주는 미생물들이 공존하기 때문에 단일배양보다 효율적일 수 있다[27]. 그러나 실제 산업체에서 배출되는 고농도의 1,4-dioxane이 포함된 폐수를 처리하거나, 실제 현장(in situ)에 적용을 위한 연구는 상대적으로 미미한 실정이다.
1,4-Dioxane의 미생물학적 제거에 있어서 환경적 요인들이 이 화학물질의 분해에 영향을 미친다는 연구결과들이 발표되어왔다. 온도, pH 등의 환경적 요인이 변화함에 따라 1,4-dioxane 분해능이 향상되었으며[22], yeast extract, tetrahydrofuran, 1-butanol, root extract 등의 부가물질을 첨가함으로써 1,4-dioxane 분해능이 증진된다는 결과들이 보고된 바 있다[19-23].
본 연구에서는 산업폐수로부터 1,4-dioxane을 분해할 수 있는 미생물컨소시엄 CDIK-3을 확보하여, 이 배양에서 여러 가지 물리적 요인(예, 기질 농도, pH, 온도) 및 부가탄소원 및 질소원(예, glucose, yeast extract, ethylene glycol, tetrahydrofuran)이 1,4-dioxane 분해에 미치는 영향을 비교 분석하였다.
2. 재료 및 방법
2.1. 세균의 분리 및 배양
울산 지역의 S 공단에서 채취한 폐수 표본으로부터 농화 배양 기법을 통하여 1,4-dioxane을 분해할 수 있는 3개의 미생물컨소시엄(CDIK-1, CDIK-2, CDIK-3)을 확보하였다. 사용된 배지는 ammonium mineral salts (AMS)였으며, 증류수 1 L당 0.66 g (NH4)2SO4, 1.0 g MgSO4∙7H2O, 0.015 g CaCl2∙2H2O, 1.0 mL AMS trace elements(증류수 1 L당 0.5 g FeSO4∙7H2O, 0.4 g ZnSO4∙7H2O, 0.02 g MnSO4∙H2O, 0.015 g H3BO3, 0.01 g NiCl2∙6H2O, 0.25 g EDTA, 0.05 g CoCl2∙6H2O, 0.005 g CuCl2∙2H2O), 1 mL AMS stock A(증류수 1 L당 5.0 g Fe-Na EDTA, 2.0 g NaMoO4∙2H2O), 20.0 mL 1.0 M phosphate buffer(증류수 1 L당 113.0 g K2HPO4, 47.0 g KH2PO4)를 포함하는 기본 배지에 단일 탄소원으로 1,4-dioxane (250~1,500 mg/L)이 첨가된 배지를 사용하였다. 준비된 배지는 pH 7.0으로 조절한 후 고압멸균하였으며, 폐수를 접종 후 진탕배양기(25℃, 150 rpm)에서 호기적으로 배양하였다. 한 달 동안 7일 간격으로 농화 배양의 10% (v/v)를 신선한 AMS에 계대 배양하며, 1,4-dioxane 분해능이 가장 우수한 미생물컨소시엄 CDIK-3을 본 연구에 사용하였다.
2.2. 1,4-Dioxane의 분석
1,4-Dioxane 농도를 측정하기 위하여 HPLC를 사용하였다. 분석에 사용된 HPLC system은 UV/Visible Detector 2489, Isocratic HPLC Pump 1515와 Autosampler 2707가 부착된 Waters 사(Milford, MA, USA)의 HPLC였으며, 컬럼은 Agilent 사(Santa Clara, CA, USA)의 Eclipse XDB-C18 (4.6 x 250 mm, 5 µm)을 사용하였다. HPLC 작동조건으로 유속은 1 mL/min, UV 파장은 200 nm로 설정하였으며, 이동상(mobile phase)은 12% acetonitrile을 0.45 µm membrane filter에 여과하고, 초음파세정기를 이용하여 용액 내의 기포를 제거한 후 사용하였다[28]. 표준물질은 분석용 고순도 1,4-dioxane (Sigma Co., St. Louis, MO, USA)을 사용하였으며, 분석 시료는 배양액을 13,000 rpm에서 10분간 원심분리 후, 상등액을 0.45 µm syringe filter로 여과하여 사용하였다.
2.3. 1,4-Dioxane 분해에 물리적 요인이 미치는 영향
미생물컨소시엄 CDIK-3에서 물리적 요인으로서, 기질 농도, pH, 온도의 변화가 1,4-dioxane의 분해에 미치는 영향을 조사하였다.
1) 기질 농도: CDIK-3의 1,4-dioxane 분해에서 기질 농도가 미치는 영향을 조사하였다. 기질로서 1,4-dioxane 농도에 따른 분해능을 비교하였으며, 250 mg/L, 500 mg/L, 750 mg/L, 1,000 mg/L, 1,250 mg/L, 1,500 mg/L의 1,4-dioxane을 포함하는 각각의 배지에 10%의 CDIK-3을 접종하여 생장 및 1,4-dioxane 분해를 비교하였다.
2) pH: 1,4-Dioxane의 분해에 있어서 초기 pH가 1,4-dioxane 분해에 미치는 영향을 비교하였다. 1,000 mg/L의 1,4-dioxane이 포함된 배지에 초기 pH를 1 N HCl과 1 N NaOH를 사용하여, 각각 6, 7, 8, 또는 9로 조절된 배지에 10%의 CDIK-3을 접종하여 생장 및 1,4-dioxane 분해를 비교하였다.
3) 온도: 배양 온도에 따른 1,4-dioxane 분해능을 비교하였다. 1,000 mg/L의 1,4-dioxane이 포함된 배지에 10%의 CDIK-3을 접종한 후, 20, 25, 30, 35℃에서 각각 배양하며, 생장 및 1,4-dioxane 분해를 비교하였다.
2.4. 부가탄소원 및 질소원이 1,4-dioxane 분해에 미치는 영향
미생물컨소시엄 CDIK-3에서 부가탄소원 및 질소원의 종류와 농도에 따른 1,4-dioxane의 분해에 미치는 영향을 조사하였다. 선택한 부가탄소원 및 질소원은 가장 보편적인 탄소원으로 glucose, 질소원 및 탄소원으로 널리 알려진 yeast extract, 그리고 보통 난분해성 화합물들의 생분해에서 공동대사를 통해 분해의 효율을 증진시키는 것으로 알려진 ethylene glycol과 tetrahydrofuran을 선택하여 본 연구에 사용하였다[19-23]. 각 배지에 CDIK-3을 접종한 후, 진탕배양기(30℃, 150 rpm)에서 배양하며, 생장과 1,4-dioxane 분해를 조사하였다.
1) Glucose: 1,4-Dioxane (1,000 mg/L)이 포함된 배지에 glucose(각각 0, 10, 20, 30, 40, 50 mg/L)를 첨가하여 1,4-dioxane 분해에 미치는 영향을 조사하였다.
2) Yeast extract: 1,4-Dioxane (1,000 mg/L)이 포함된 배지에 yeast extract(각각 0, 10, 20, 30, 40, 50 mg/L)를 첨가하여 1,4-dioxane 분해에 미치는 영향을 조사하였다.
3) Ethylene glycol: 1,4-Dioxane (1,000 mg/L)이 포함된 배지에 ethylene glycol(각각 0, 100, 200, 300 mg/L)을 첨가하여 1,4-dioxane 분해에 미치는 영향을 조사하였다.
4) Tetrahydrofuran: 1,4-Dioxane (1,000 mg/L)이 포함된 배지에 tetrahydrofuran(각각 0, 50, 100, 150, 200 mg/L)을 첨가하여 1,4-dioxane 분해에 미치는 영향을 조사하였다.
3. 결과 및 고찰
3.1. 미생물컨소시엄 CDIK-3의 분리 및 배양
울산 지역에 있는 S 공단의 원수저장조, 침전조, 포기조의 3곳에서 폐수 시료를 채취하여, 농화배양 기법으로 1,4-dioxane 을 탄소원으로 이용하는 3가지 미생물컨소시엄을 확보하였으며, 각각 CDIK-1, CDIK-2, CDIK-3로 명명하였다. 이들 가운데, CDIK-3는 1,4-dioxane의 분해능이 가장 우수한 컨소시엄으로 조사되었으며, 연속적인 실험을 위하여 배양 중에 균주의 대수기를 식별하여 새로운 배지에 연속 계대배양한 후, 진탕배양기(25℃, 150 rpm)에서 유지시키며, 생장 및 1,4-dioxane 분해를 관찰하는데 사용하였다.
3.2. 미생물컨소시엄 CDIK-3의 생장과 1,4-dioxane 분해
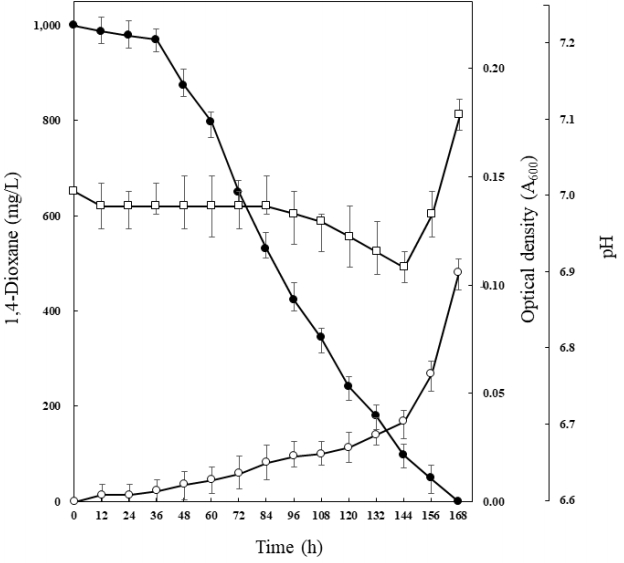
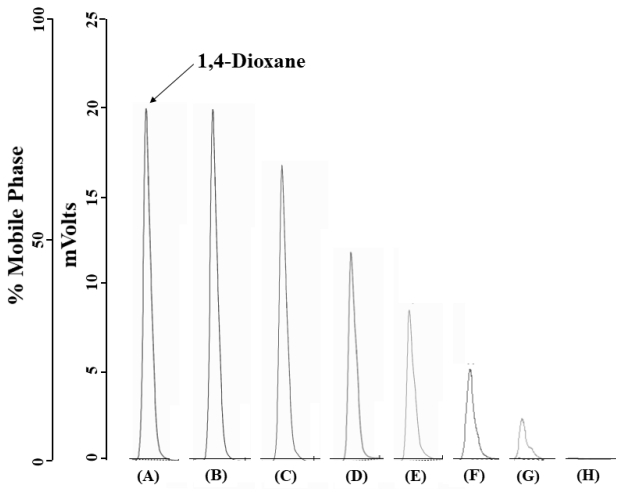
미생물컨소시엄 CDIK-3에 의한 1,4-dioxane 분해와 미생물 생장, 그리고 배양기간 중의 pH 변화를 관찰하였다. 배지 내의 1,4-dioxane의 농도는 1,000 mg/L였으며, 초기 pH는 7.0이었다(Fig. 1). 배양 36시간부터 1,4-dioxane이 급격한 감소가 시작되었으며, 1,000 mg/L의 1,4-dioxane은 168시간 이내에 완전히 분해되었다. CDIK-3의 생장은 접종 후 36시간부터 서서히 증가하기 시작하였으며, 144시간부터 급격하게 생장하였다. 배양 기간 중에 pH 변화는 크게 변화가 없었는데, 초기 7.0에서 서서히 감소되어, 배양 후 144시간에 pH 6.9로 가장 낮게 측정되었으며, 이후, pH는 점차 증가하여 168시간에 이르러 7.1로 측정되었다. 배양 내의 잔존 1,4-dioxane은 HPLC로 분석하였으며, HPLC chromatogram에서 1,4-dioxane의 retention time은 4.00분에서 확인되었으며, 별도의 주요 피크는 나타나지 않았다. 배양 후, 24시간마다 채취한 시료에서의 잔존 1,4-dioxane의 peak 변화는 Fig. 2에서 보여주고 있다.
3.3. 1,4-Dioxane 분해에 물리화학적 요인이 미치는 영향
3.3.1. 기질 농도
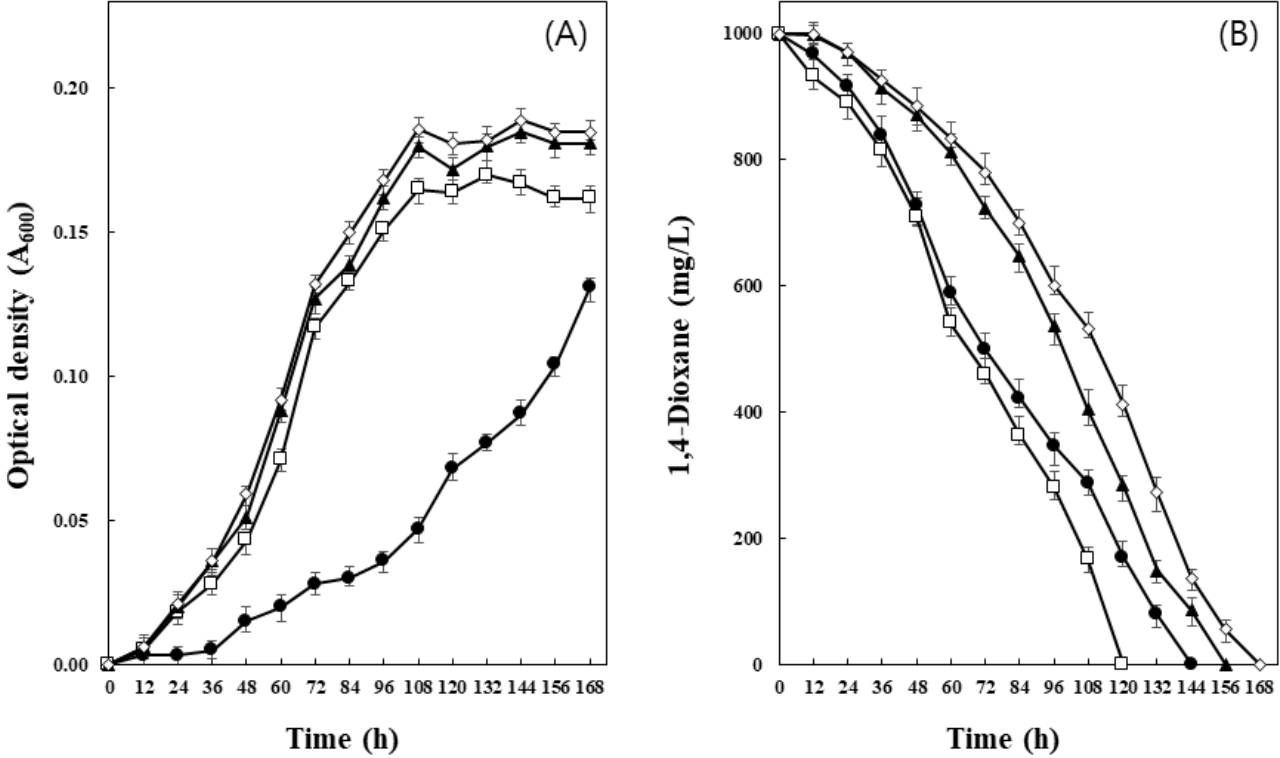
기질로서 초기 1,4-dioxane 농도에 따른 미생물컨소시엄 CDIK-3의 생장과 1,4-dioxane 분해에 미치는 영향을 관찰하였다(Fig. 3). 접종한 후 48시간이 경과하면서 뚜렷한 생장이 관찰되었으며, 1,250 mg/L와 1,500 mg/L의 1,4-dioxane이 첨가된 배지에서 가장 높은 생장률을 나타내었다. 1,4-Dioxane 분해는 접종 후 36시간부터 1,4-dioxane 농도가 서서히 감소하였으며, 250 mg/L, 500 mg/L, 750 mg/L, 1,000 mg/L의 1,4-dioxane은 각각 72시간, 96시간, 120시간, 168시간 이내에 완전히 분해되었다. 그러나 1,4-dioxane의 농도가 1,250 mg/L와 1,500 mg/L로 증가함에 따라, 주어진 배양기간인 168시간 동안에 각각 80%와 67%의 부분적인 분해가 진행되었다. Kim 등[18]이 분리한 Mycobacterium sp. PH-06은 15일 동안 900 mg/L의 1,4-dioxane을 분해하였으며, Pugazhendi 등[20]은 Rhodanobacter AYS5를 이용하여 10일 동안 950 mg/L의 1,4-dioxane이 제거됨을 발표하였다. 또한, Nakamiya 등[19]은 Cordyceps sp.을 이용한 연구에서 3 mg/L의 1,4-dioxane을 3일 이내에 분해하였으며, Inoue 등[22]이 분리한 Rhodococcus aetherivorans JCM 14343은 20 mg/L 1,4-dioxane을 약 30시간 이내 분해한다고 보고한 바 있다. 이들 결과와 비교하여, 본 연구에서 분리한 CDIK-3은 250 mg/L의 1,4-dioxane을 72시간 이내, 그리고 1,000 mg/L의 1,4-dioxane도 168시간 이내에 완전히 분해하여, 기존에 발표된 미생물들과 비교하여 1,4-dioxane의 분해능이 탁월한 것으로 판단된다.
3.3.2. pH
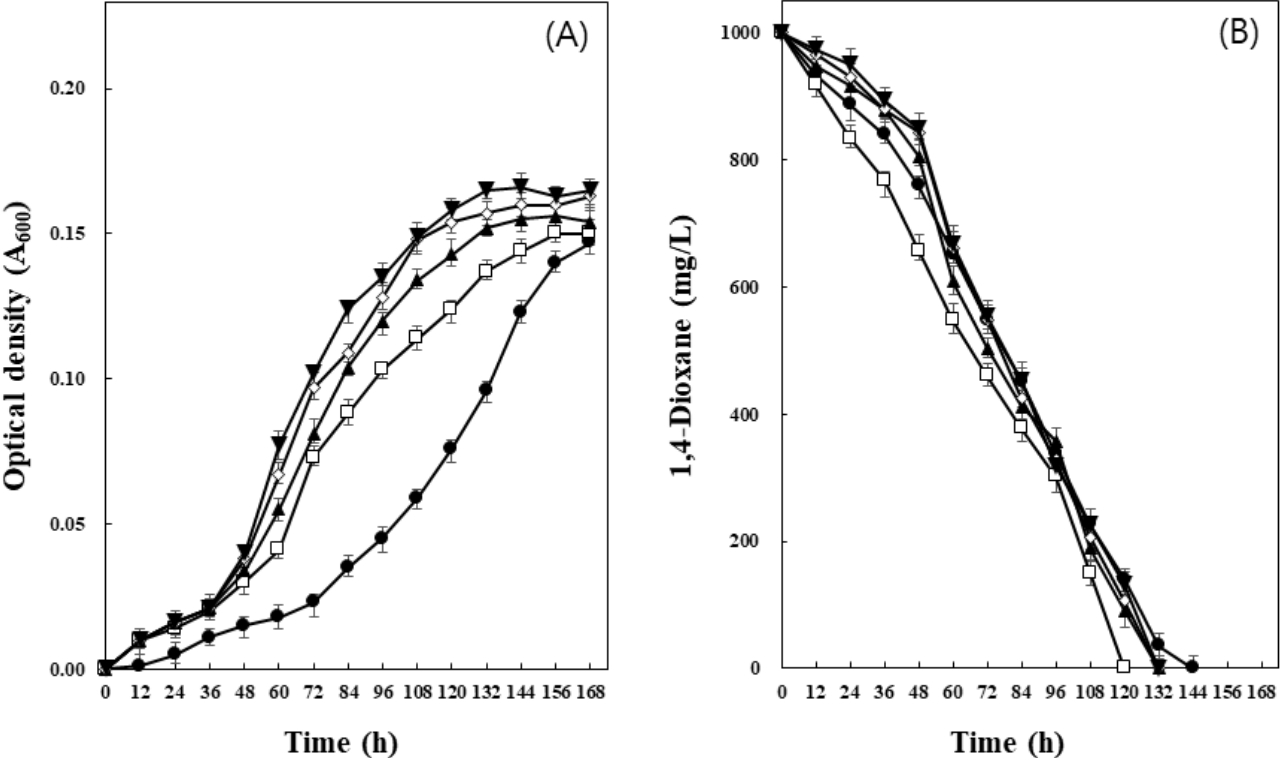
미생물컨소시엄 CDIK-3을 이용하여 1,4-dioxane의 분해에 있어서 최적 pH를 알아보기 위하여, 초기 pH를 조절하여 분해와 생장에 미치는 영향을 관찰하였다(Fig. 4). 초기 pH를 6.0으로 조정하여 1,4-dioxane의 분해를 관찰한 결과 168시간 동안 약 90%의 분해를 나타내었다. 반면 초기 pH 7.0과 8.0의 경우에는 각각 168시간, 144시간 이내에 완전 분해를 보여주었으며, pH 9.0인 경우에서도 약 97%의 분해를 나타내었다. Inoue 등[22]이 분리한 Rhodococcus aetherivorans JCM 14343은 pH 7.0에서 20 mg/L의 1,4-dioxane을 48시간 이내 분해하였으며, pH 8.0과 pH 9.0에서는 1,4-dioxane 분해능이 약 10% 감소하는 결과를 보고하였다. 그러나 본 연구에서 분리한 CDIK-3은 생장과 1,4-dioxane 분해에 있어서 pH 환경이 비교적 약산성보다는 약알칼리에서 적응 능력이 높았으며, 분해도 효과적인 것으로 분석되었다.
3.3.3. 온도
미생물컨소시엄 CDIK-3 배양이 1,4-dioxane 분해와 생장에 미치는 최적 온도를 알아보기 위하여 본 실험을 수행하였다(Fig. 5). 그 결과, 배양 온도가 20℃인 경우에 168시간 동안 배지 내의 1,4-dioxane 중 약 90%가 분해되었으며, 생장에서도 수행된 다른 온도와 비교하여 생장이 다소 저조한 것이 관찰되었다. 25℃와 35℃에서는 각각 168시간 이내에 완전히 제거되는 것으로 나타났으며, 특히 30℃에서 배양하였을 경우 156시간 이내에 완전히 분해되어, CDIK-3의 1,4-dioxane 분해에 있어서 최적 온도는 30℃로 조사되었다. Inoue 등22)이 분리한 Rhodococcus aetherivorans JCM 14343의 경우 28℃에서 20 mg/L의 1,4-dioxane을 48시간 이내 분해하였으며, 20℃와 35℃에서는 분해능이 약 10% 감소하는 결과를 보고한 바 있는데, 이 결과는 본 연구에서 얻어진 결과와 유사하였다.
3.4. 부가탄소원 및 질소원의 첨가에 따른 생장 및 1,4-dioxane의 분해
3.4.1. Glucose
부가탄소원으로서 glucose를 첨가하여 미생물컨소시엄 CDIK-3의 생장과 1,4-dioxane 분해에 미치는 영향을 조사하였다(Fig. 6). Glucose가 첨가된 배지에서 생장은 증가하였으며, 첨가된 glucose의 농도가 증가할수록 높은 생장률을 나타내었다. 10 mg/L의 glucose가 첨가된 경우에, glucose를 첨가하지 않은 경우와 마찬가지로 1,4-dioxane은 144시간 이내에 완전 분해되는 동일한 결과가 나타났다. 20-50 mg/L의 glucose를 첨가한 경우에서도 완전 분해 기간은 각각 132시간 이내로, 첨가하지 않은 것과 비교하여 분해능은 다소 향상되었으나, 궁극적으로 첨가된 glucose의 농도에 따른 1,4-dioxane의 분해의 차이는 미미한 것으로 조사되었다. 일부 과학자들은 부가탄소원으로서 glucose의 첨가가 1,4-dioxane의 분해를 저해시키는 결과를 가져오는 것으로 보고하였다. Pugazhendi 등[20]이 분리한 Rhodococcus aetherivorans JCM 14343은 pH 7.0에서 20 mg/L의 1,4-dioxane을 48시간 이내 분해하였으며, pH 8.0과 pH 9.0에서는 1,4-dio은 Rhodanobacter AYS5를 이용한 연구에서 100 mg/L의 1,4-dioxane에 glucose를 첨가한 경우, 분해능이 약 40% 감소하였으며, Kelley 등[23]이 분리한 Rhodococcus aetherivorans JCM 14343은 pH 7.0에서 20 mg/L의 1,4-dioxane을 48시간 이내 분해하였으며, pH 8.0과 pH 9.0에서는 1,4-dio의 연구에서도 glucose를 첨가함으로 25 mg/L의 1,4-dioxane이 완전 분해되는데 소요되는 기간이 약 17일에서 21일로 지연되면서 1,4-dioxane 분해능이 감소함을 보고한 바 있다. 그러나 CDIK-3의 경우 glucose 첨가함으로써 1,4-dioxane 분해능이 약 10% 향상되었는데, 이는 CDIK-3 배양에 존재하는 1,4-dioxane을 분해하는 미생물들이 먼저 glucose를 소비하여 짧은 시간 내에 급격하게 생장하고 결국 이들에 의한 1,4-dioxane의 분해가 향상된 것으로 판단된다.
3.4.2. Yeast extract
미생물컨소시엄 CDIK-3 배양에 다른 농도의 yeast extract를 첨가한 후, 생장과 1,4-dioxane 분해에 미치는 영향을 관찰하였다(Fig. 7). Yeast extract를 첨가한 경우는 첨가하지 않은 것과 비교하여 생장률이 급격히 증가하였으며, yeast extract의 농도가 증가할수록 높은 생장률을 나타내었다. 10-40 mg/L의 yeast extract가 첨가된 경우에 완전히 분해되는데 소요되는 시간은 모두 132시간 이내로 동일한 것으로 나타났으며, 50 mg/L가 첨가된 경우는 120시간 이내에 완전 분해됨으로써 yeast extract를 첨가하지 않은 것 보다 1,4-dioxane 분해능이 크게 향상되었다. Pugazhendi 등[20]은 Rhodanobacter AYS5 배양에 포함된 1,000 mg/L의 1,4-dioxane이 10일 동안 약 95%를 분해되었으나, yeast extract가 첨가된 상태에서 배양 9일 만에 완전히 분해되었음을 보고하였다. Yeast extract에는 다양한 아미노산과 펩타이드, 수용성 비타민, 탄수화물 등이 포함되어 있어 많은 미생물에서 우수한 기질로 사용되는데, 본 연구에서 얻어진 결과는 CDIK-3이 이들 성분들을 생장인자로 이용할 뿐만 아니라, 포함된 질소원으로 인해 탄소-질소 비율(C/N ratio)을 변화시켜 대사활성을 증진시킴으로써 궁극적으로 생장과 1,4-dioxane 분해를 향상시키는 것으로 판단된다.
3.4.3. Ethylene glycol
미생물컨소시엄 CDIK-3 배양에서 ethylene glycol의 첨가에 따른 생장과 1,4-dioxane 분해를 조사하였다(Fig. 8). Ethylene glycol을 첨가한 경우, 생장은 급격히 증가하였으며, ethylene glycol의 농도가 증가할수록 높은 생장률을 나타내었다. 1,4-Dioxane 분해는 100 mg/L, 200 mg/L, 300 mg/L의 ethylene glycol을 첨가하였을 때, 배양 후 각각 120시간, 156시간, 168시간 이내에 완전히 분해되었으나, 그 농도가 증가함에 따라 완전분해에 도달하는데 걸리는 시간은 점차 늘어났다. Inoue 등[22]은 ethylene glycol를 첨가함으로 1,4-dioxane 분해능은 첨가하지 않은 것과 비교하여 약 30%가 감소하였으며, Nakamiya 등[19]도 ethylene glycol이 1,4-dioxane 분해를 억제하는 것으로 보고하였다. 그러나 본 연구에서 CDIK-3 배양의 1,4-dioxane 분해는 저농도(≤100 mg/L)의 ethylene glycol를 첨가한 경우, 1,4-dioxane보다 이용이 용이한 ethylene glycol을 먼저 소비하여 짧은 시간 내에 급격하게 생장 및 분해가 진행되었으며, ethylene glycol 농도(≥200 mg/L)가 증가함에 따라 1,4-dioxane 분해는 점차 억제되는 것으로 나타났다. 배양에서 ethylene glycol 첨가에 따른 미생물의 생장과 1,4-dioxane의 분해와의 상관관계는 연구가 필요할 것으로 사료된다.
3.4.4. Tetrahydrofuran
미생물컨소시엄 CDIK-3 배양에서 tetrahydrofuran의 첨가에 따른 생장과 1,4-dioxane 분해에 미치는 영향을 조사하였다(Fig. 9). Tetrahydrofuran이 첨가된 것과 첨가되지 않은 것에 비교하여 뚜렷한 차이를 나타내었다. CDIK-3의 생장은 첨가된 tetrahydrofuran 농도가 증가할수록 높은 생장률을 나타내었다. 1,4-Dioxane 분해는 50 mg/L tetrahydrofuran의 경우, 120시간 이내에 완전히 분해되어, 첨가하지 않은 것보다 분해능이 크게 향상되었다. 100-200 mg/L tetrahydrofuran 첨가에서도 각각 132시간 이내 완전 분해되면서 미첨가된 것과 비교하여 분해능이 향상되었지만, 농도에 따른 1,4-dioxane 분해는 거의 유사하였다. 몇몇 연구에서 미생물 배양에 부가탄소원으로 tetrahydrofuran의 첨가가 1,4-dioxane의 분해에 미치는 영향에 대하여 발표된 바 있는데, 미첨가된 경우와 비교하여 Rhodanobacter AYS5에서 약 30% [20], 그리고 Amycolata sp. CB1190에서 약 40%23)의 1,4-dioxane의 분해가 각각 향상되었다는 결과가 보고되었다. Masuda 등[29]은 Pseudonocardia sp. strain ENV478에서 tetrahydrofuran monooxygenase (thm)를 확인하였으며, 배양에서 tetrahydrofuran의 농도가 증가함에 따라 thm 유전자가 유도됨을 보고하였다. Tetrahydrofuran은 세균을 빠르게 생장시키며 공동대사(co-metabolism) 방식으로 1,4-dioxane을 분해할 수 있는 것으로 알려져 있다[30], Zenker 등[24]은 tetrahydrofuran의 존재 하에서 혼합배양의 공동대사에 의해 200 mg/L의 1,4-dioxane을 약 12일 이내 완전 분해한 결과를 보고하였다. 이들 연구와 비교하였을 때, 본 연구에서 이용한 미생물컨소시엄 CDIK-3에서도 유사한 결과를 보여주었는데, 이는 tetrahydrofuran이 1,4-dioxane을 제거하는데 훌륭한 부가탄소원이 될 수 있다고 생각된다.
1,4-Dioxane은 고리형 에테르 화합물로서 다양한 산업에서 널리 사용되며, 이 화합물이 포함된 산업폐수는 하천, 호수, 지하수 등의 수계를 오염시키고 있다. 현재 1,4-dioxane의 처리는 화학적 처리에 의존하고 있지만, 처리 비용 및 2차 오염의 문제가 되고 있어, 이들 문제를 해결하기 위한 방법으로 미생물학적 처리의 가능성을 연구하였다. 본 연구에서 사용된 미생물컨소시엄 CDIK-3에 의한 1,4-dioxane의 농도는 지금까지 보고된 결과들과 비교하여 현저하게 높은 것으로 조사되었으며, 여러 가지 물리화학적 요인의 조절이나 적절한 부가탄소원 및 질소원의 첨가에 의해 1,4-dioxane의 분해가 증진될 수 있음이 확인되었다. 향후 연구는 미생물컨소시엄 CDIK-3을 이용하여 1,4-dioxane이 포함된 산업폐수의 효율적인 처리와 현장 적용, 그리고 분리된 단일 균주들의 특성을 규명으로 방향으로 진행될 것이다.
4. 결 론
미생물컨소시엄 CDIK-3의 생장과 1,4-dioxane의 분해에 미치는 여러 가지 물리화학적 환경요인에 대한 결론은 다음과 같다:
1) 1,4-Dioxane의 초기 농도(250-1,500 mg/L)가 증가함에 따라 생장도 증가하였으며, 1,000 mg/L의 1,4-dioxane은 168 시간 이내에 완전히 분해되었다. 그러나 1,4-dioxane의 농도가 1,250 mg/L와 1,500 mg/L로 증가함에 따라, 주어진 배양 기간인 168시간 동안에 각각 80%와 67%의 부분적인 분해가 진행되었다.
2) 초기 pH 8.0에서 1,000 mg/L의 1,4-dioxane은 144시간 이내에 완전분해되었으며, 최대 생장을 보여주었다. pH 7.0에서도 동일 농도의 1,4-dioxane은 168시간에서 완전분해되었으나, pH 6.0과 9.0에서는 약 90%로 분해가 저조하였다.
3) 배양 온도(20-35℃) 조절에 따른 1,4-dioxane 분해는 30℃가 최적 온도로 확인되었으며, 156시간 이내에 1,000 mg/L의 1,4-dioxane이 완전히 분해되었다.
4) 부가탄소원으로서 glucose (10-50 mg/L)를 첨가한 경우에, CDIK-3의 생장은 첨가된 glucose 농도에 비례하였으며, 1,000 mg/L의 1,4-dioxane이 132시간 이내에 완전히 분해되었다.
5) Yeast extract 농도(10-50 mg/L)가 증가함에 따라 CDIK-3는 급격히 생장하였으며, 50 mg/L가 첨가된 경우에 1,000 mg/L의 1,4-dioxane이 120시간 이내에 완전히 분해되었다.
6) 100 mg/L ethylene glycol이 첨가되었을 때, 1,000 mg/L의 1,4-dioxane이 120시간 이내에 완전히 분해되었으나, 첨가농도(100-300 mg/L)가 증가함에 따라 1,4-dioxane 분해는 지연되었다.
7) 50 mg/L의 tetrahydrofuran이 첨가되었을 때, 1,000 mg/L의 1,4-dioxane은 120시간 이내에 완전히 분해되어 첨가하지 않은 것보다 분해능이 향상되었으나, 농도 증가(50-100 mg/L)에 따른 분해능은 거의 유사하였다. 이들 결과에 근거한 다양한 환경요인들을 최적화시킴으로써 산업폐수에 포함된 1,4-dioxane을 미생물을 이용하여 효율적으로 제거할 수 있을 것으로 판단된다.