The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
RuO2/Ti 양극과 TiO2 nanotube 음극을 이용한 고농도 암모니아 전기분해
Abstract
Objectives
In this study, the treatment potential of ammonia in wastewater generated by S company odor removal process was tested by using electrochemical reactor with RuO2/Ti anode and TiO2 nanotube cathode. The effect of chlorine ion concentration and current density on ammonia oxidation were investigated by comparing the treatment efficiencies.
Methods
380 mL of wastewater was electrolyzed for 3 h using 4 anodes and 5 cathodes and pH, NH3-N, NO3--N, and TN were measured and analyzed every 30 minutes.
Results and Discussion
As the addition of chlorine ion increases, about 1,700 mg/L of ammonia in the wastewater was found to increase in oxidation reaction rate due to an increase in chlorine based oxidizing agent. An increase in chlorine based oxidizing agent leads to an increase in indirect oxidation. As a result, total nitrogen removal was increased. Ammonia oxidation rate was increased as the current density increased. Nitrate, ammonia oxidation byproduct, was accumulated at a current density from 20 to 40 mA/cm2. At higher than 50 mA/cm2, nitrate was accumulated for a while and then decreased. Total nitrogen removal rate increased as the current density increased. During electrochemical oxidation of ammonia to nitrate, hydroxyl ions were consumed by the reaction. The hydroxyl ion consumed during ammonia oxidation was less than that produced from nitrate reduction.
Conclusions
Thus, ammonia in actual wastewater was completely removed using RuO2/Ti anode and TiO2 nanotube cathode and the possibility of reducing nitrate was confirmed. We confirmed the applicability of the two electrodes to the real industry.
Key words: Electrolysis, Ruthenium Catalytic Electrode, TiO2 Nanotube, Nitrogen Wastewater
요약
목적
본 연구에서는 RuO2/Ti와 TiO2 nanotube를 각각 양극과 음극으로 사용하여 S사의 악취제거 공정에서 발생한 폐수 속 암모니아에 대한 처리 가능성을 확인하고 암모니아 산화에 미치는 영향인자로서 염소 이온 농도, 전류밀도에 따른 처리효율을 비교하고자 하였다.
방법
폐수 380 mL를 양극 4개와 음극 5개를 이용하여 3시간 동안 전기분해하였고, 30분마다 pH, NH3-N, NO3--N, TN를 측정하여 분석하였다.
결과 및 토의
폐수 속 약 1,700 mg/L의 암모니아는 염소 이온이 증가할수록 염소계 산화제의 증가로 인한 간접 산화 반응의 증가로 산화 반응속도가 증가하는 것으로 나타났다. 전류밀도에 따른 암모니아의 산화 속도 비교 실험에서 전류밀도가 증가할수록 암모니아의 산화 반응이 증가하는 것으로 나타났다. 암모니아 산화 부산물인 질산염은 전류밀도가 20 mA/cm2에서 40 mA/cm2까지 실험의 경우에는 반응기 내에 축적되었지만 50 mA/cm2 이상의 전류밀도 실험에서는 증가하였다가 감소하는 경향을 보였고 따라서 총질소의 제거는 전류밀도가 증가함에 따라 증가하는 것으로 나타났다. 총질소 또한 전류밀도가 증가함에 따라 암모니아 감소의 영향으로 제거율이 증가하였다. 암모니아의 전기화학적 산화 시 질산염이 생성되는 반응 동안의 수산화 이온의 소비보다 음극에서의 질삼염의 환원 반응에 의해 생성되는 수산화 이온이 더 많아 pH가 증가하는 것으로 나타났다.
결론
따라서 RuO2/Ti와 TiO2 nanotube를 사용하여 실제 폐수 속 암모니아를 완전히 제거하였고 질산염의 저감 가능성을 확인하여 두 전극의 실제 폐수 처리 공정에의 적용 가능성을 확인하였다.
주제어: 전기분해, 루테늄 촉매 전극, TiO2 나노튜브, 질소 폐수
1. 서 론
급속한 도시화와 활발한 산업화로 인해 공장과 농・축산 시설, 매립시설, 하폐수 처리시설과 같은 다양한 분야와 생활 속에서 발생하는 폐수는 발생량의 증가와 더불어 더욱 고농도의 질소를 포함하게 되었다[ 1- 3]. 고농도 질소 폐수는 방류 시 부영양화, 적조, 녹조 현상, 생태독성 등 환경적인 문제를 야기하여 수중 생태계를 파괴하는데 특히 암모니아 질소는 상수에 고농도로 존재 시 불쾌한 냄새를 유발하고 발암물질로써 인체에 유해할 뿐만 아니라 소독에 필요한 염소 요구량을 증가시키기 때문에 방류 전 제거가 필수적이다. 질소뿐만 아니라 폐수 속 오염물질을 처리하여 지속 가능한 수자원을 확보하는 것도 전세계적으로 극복해야할 문제가 되었다[ 4- 8]. 폐수 속 질소는 그 형태와 농도에 따라 다양한 생물학적, 물리화학적 기술로 처리되고 있고 그 중 암모니아는 탈기(stripping), 탈질화(denitrification), 파괴점 염소주입(breakpoint chlorination), 전기분해(electrolysis) 등의 방법으로 제거될 수 있다. 이 중 전기분해는 금속의 산화・환원 원리를 이용하여 오염물질을 선택적으로 분해하여 제거하는 전기화학적 처리기술이다. 전기분해 공법은 생물학적, 물리화학적 방법에 비해 장치 구성이 간단하고 공정이 단순하여 요구되는 부지가 적을 뿐만 아니라 추가적인 약품 투입량이 적고 슬러지 발생량이 적어 처리수의 수질이 높다는 점 등 여러 장점이 있어 기존의 질소 처리 기술을 대체할 방법으로 활발히 연구되고 있다[ 9]. 전기분해를 통한 질소 제거에 관한 연구는 질산성 질소의 환원과 암모니아성 질소의 산화로 구분되고, 전기분해 효율에 영향을 미치는 영향 인자로 전극의 종류를 포함하여 pH, 전류밀도, 전기 전도도, 염소 이온 농도, 초기 암모니아 농도, 전극 간격 등이 연구되었다[ 10- 16]. 전기화학적으로 암모니아를 산화시켜 제거하는 방법은 크게 직접 산화와 간접 산화로 나눌 수 있다. 양극에서 암모니아는 식 (1) ~ (4)과 같은 반응으로 직접 산화되면서 양극 표면에 흡착된 후 질소 가스로 제거된다[ 17, 18]. 양극에서는 용해된 염소 이온이 식 (5), (6)을 거쳐 차아염소산이 생성되는 반응도 일어난다. 강력한 산화제인 차아염소산과 차아염소산이 산화된 차아염소산 이온은 식 (7) ~ (10)과 같은 반응으로 용액 속 암모니아를 간접적으로 산화시켜 제거한다는 것이 많은 연구자들에 의해 입증되었다[ 19- 26]. 또한 암모니아는 식 (11), (12)와 같이 수산화 이온에 의해 간접적으로 제거되어 질산성 질소로 산화된다[ 18]. 식 (13)의 암모니아 - 암모늄 이온과 마찬가지로 식 (14)의 차아염소산 - 차아염소산 이온 또한 pH에 따라 평형 관계를 이루는 화합물로, 암모니아의 제거는 pH에 의해 영향을 받는다. pH 12 이상인 염기 용액에서 암모니아는 직접 산화되고 pH 7 이하인 산 용액에서 산화제에 의해 간접 산화되어 분해된다는 것이 입증되었다[ 27, 28]. 음극에서는 질산성 질소가 식 (15)의 수소 생성 반응과 더불어 식 (16) ~ (21)과 같이 질소, 산화질소, 암모니아 등으로 환원되어 제거된다. 암모니아의 산화로 생성된 질산염과 아질산염 같은 질산성 질소도 환원되는데 일부는 암모니아로 재환원되기도 한다[ 29- 32]. 이러한 전기화학적 반응에서 염소가스 생성 효율을 높이고 산화 반응을 촉진시키기 위해 불용성 전극(DSA, Dimensionally Stable Anode)이 사용된다. 불용성 전극은 내구성이 뛰어난 모재 위에 촉매 역할을 하는 산화금속을 올린 전극으로 열적, 화학적으로 안정적이며 저항이 적고 산화제 역할을 하는 염소 가스 발생률이 높다는 장점이 있어 전기화학적 수처리의 산화 전극으로 주로 사용되고 있다[ 33, 34]. 그 중에서도 특히 Ru 또는 Ir 같은 귀금속 촉매를 코팅한 DSA 전극의 질소 제거 효율이 높다고 알려져 있다[ 35]. 환원전극인 음극 또한 다양한 재질이 연구되어 질산성 질소의 환원에 사용되고 있다. 그 중 나노튜브 형태로 제작한 TiO 2가 화학적으로 안정하고 구조상 비표면적이 넓기 때문에 용해된 이온이 접촉할 수 있는 부분이 많아 환원 반응의 효율이 높다고 알려져 있다[ 36]. 또한 높은 전기용량을 가지고 있어 전기화학적 특성도 뛰어날 뿐만 아니라 인체에 무해하고 2차 오염 발생이 없어 수처리에서 고도산화처리기술 뿐만 아니라 광촉매로도 활용되고 있다[ 37].
Table 1에 전기분해를 이용하여 폐수 속 암모니아를 제거한 최근 연구들을 정리하였다. Table 1에서 확인할 수 있듯이 폐수 속 질소 제거에 관한 연구의 대부분이 처리 효율이 높지 않거나 질소 농도가 낮은 합성 폐수가 사용되었기 때문에 실제 산업이나 처리장에서 발생하는 고농도 질소 폐수를 적용한 연구는 미비한 실정이라 실제 폐수 처리 공정에 전기분해 공법을 사용하기에 어려움이 있다. 따라서 본 연구에서는 DSA 전극의 실제 고농도 질소 폐수 처리 여부를 확인하고 염소 이온 농도와 전류밀도를 영향 인자로 설정하여 대표적인 두 영향 인자에 따른 처리 효율을 비교분석하고자 한다.
2. 실험 장치 및 실험 방법
2.1. 전극 제조
본 연구를 진행하기 위해 사용된 전극은 티타늄(99.5%, 1 mm, 5 × 5 cm2)을 모재로 사용하였고, 산화가 일어나는 양극과 환원이 일어나는 음극의 반응 효율을 높일 수 있는 촉매전극으로 제작하였다.
음극은 TiO 2 nanotube를 사용하였다. 제작 전 표면 세척을 위해 티타늄을 acetone, ethanol, 증류수의 순으로 각각 10분 간 초음파 세척하여 표면의 유기물과 불순물을 제거한 뒤, 이전극법으로 양극산화하여 nanotube를 제작하였다. 이때 450 mL 용량의 2 vol% H 2O + 0.2 w/v% NH 4F + ethylene glycol 전해질을 사용하였다. 60 V의 정전압을 15시간 동안 인가하여 양극산화하였고 annealing을 통해 최종 전극을 제작하였다[ 42]. 양극은 루테늄을 촉매로 한 DSA 전극을 제조하였고 루테늄 귀금속 촉매가 티타늄 위에 단단하게 고정될 수 있도록 물리적, 화학적으로 전처리한 뒤 사용하였다. 먼저 티타늄을 금강사 #46으로 sand blast 처리하여 표면적을 넓히고, 표면의 산화 피막과 불순물을 제거하기 위해 10% HCl로 etching하였다. 전처리 된 티타늄에 부탄올에 녹인 RuCl 3를 brushing 기법으로 올려 Ru/Ti를 제작하였다. 마지막으로 350℃에서 가열, 냉각하여 최종적으로 RuO 2/Ti의 형태로 제작하였다[ 43].
2.2. 실험 및 분석방법
전극이 고정될 수 있도록 제작한 380 mL 용량의 아크릴 반응기에 유효 면적 5 × 5 cm 2 크기의 양극 4개와 음극 5개를 0.5 cm 간격을 두고 교대로 고정하여 Fig. 1과 같이 준비하였다. 전선의 피복을 벗겨내 전극 위쪽과 직접 연결하였고 폐수 속 반응 물질과 전극 표면의 원활한 반응을 위해 370 rpm으로 교반하며 실험을 진행하였다. 전기분해는 180분 동안 진행되었고 30분마다 샘플링하여 pH, NH 3-N, NO 3--N, TN의 네 가지 항목의 측정을 통해 폐수의 성상 변화를 관찰하였다. 시료 측정 시 pH는 pH meter(Mettler toledo, S220, U.S.A.)로 측정하였고 NH 3-N, NO 3--N, TN은 분광 광도계(HACH, DR2700, U.S.A.)로 측정하였다. 폐수 속 초기 염소 이온 농도의 측정은 이온크로마토그래피(Metrohm, 790 Personal, Switzerland)를 사용하였다. 그 외 폐수 속 원소 분석을 위해 유도결합 플라스마 질량분석기(Thermo Fisher Scientific, Germany)로 극미량 원소 분석을 수행하였다. 염소 이온에 따른 전기분해 효율을 비교하기 위해 전류밀도는 40 mA/cm2로 고정하고 NaCl을 추가하지 않은 실험, 0.5% 추가한 실험, 1.0% 추가한 실험을 진행하였다. 전류밀도에 따른 효율을 확인하는 실험에서는 염소 이온의 추가 없이 DC power supply (AMETEK XG 150-10)를 이용하여 20 mA/cm2부터 70 mA/cm2까지 10 mA/cm2씩 조절하며 정전류를 인가하여 비교하였다.
2.3. 대상 시료
실험에 사용한 실제 폐수는 S사에서 발생한 슬러지를 건조하는 과정에서 발생하는 악취를 악취제거 공정을 통해 황산, 차아염소산나트륨, 수산화나트륨으로 약액세정한 폐수로 실제 공정에서 발생하는 폐수이다. 암모니아, 트리메틸아민 계열, 알데하이드 계열, 황화메틸, 이황화메틸, VOC 물질, 황화합물 등의 휘발성 유기화합물(VOCs, Volatile Organic Compounds)을 포함하고 있다.
3. 결과
3.1. 폐수 초기 성상
Table 2에서 폐수의 초기 성상을 확인할 수 있고 Table 3에서는 폐수를 유도결합 플라스마 질량분석기로 분석한 결과를 확인할 수 있다. 초기 폐수의 pH는 8.5로 측정되었고, 염소 이온 농도는 2,600 mg/L로 측정되었다. 질소 농도는 암모니아성 질소가 1,710 ~ 2,100 mg/L, 질산성 질소는 36 ~ 40 mg/L, 총질소는 2,100 ~ 2,600 mg/L 사이에서 측정값을 확인하였다. 질소 성분 측정 시 사용한 기기의 검출 한계에 맞춰 적절한 농도로 희석하여 분석하였고, 질소 폐수 분석 특성상 측정값이 일정하지 않아 농도 범위로 나타내었다. 대부분의 원소들이 폐수 속에 1 mg/L 미만으로 존재하고 칼륨과 칼슘이 각각 3.857 mg/L, 1.629 mg/L로 존재하였다.
3.2. 암모니아의 전기화학적 산화에서 염소 이온 농도의 영향
Fig. 2에서 RuO 2/Ti 양극과 TiO 2 nanotube 음극 이용 전기분해 시스템으로 폐수를 전기분해하였을 때 염소 이온 농도에 따른 암모니아 농도 변화를 확인할 수 있다. 초기 농도 약 1,750 mg/L의 암모니아는 염소 이온을 첨가하지 않은 실험에서 180분 이내에, 0.5% 첨가한 실험에서 120분 이내에, 1.0% 첨가한 실험에서 90분 이내에 완전히 제거되었다. 수중에 염소 이온은 양극에서 강력한 산화제인 차아염소산과 차아염소산 이온으로 산화되어 표면에 흡착되고[ 34] 일부의 암모니아는 흡착된 산화제에 의해 식 (7) ~ (10) 반응과 같이 간접 산화되어 질소 가스와 질산염의 형태로 제거된다. 폐수 속 염소 이온 농도가 증가함에 따라 산화제의 농도 또한 증가하므로 암모니아 산화가 촉진되어 암모니아 제거율이 높아진 것으로 판단되고 이는 여러 선행 연구와 일치한다[ 27, 44, 45].
Fig. 3에서는 RuO 2/Ti 양극과 TiO 2 nanotube 음극 이용한 전기분해 시스템으로 폐수를 전기분해하였을 때 염소 이온 농도에 따른 질산염의 변화를 확인할 수 있다. 초기 40 mg/L 정도인 질산염은 염소 이온을 첨가하지 않은 실험에서는 전기분해 3시간 동안 약 3배까지 증가하여 111 mg/L이 측정되었다. 염소 이온을 첨가한 두 실험에서는 질산염의 농도가 증가하다가 감소한 것을 알 수 있다. 0.5% NaCl을 첨가한 실험에서 질산염은 50 mg/L까지 증가했다가 90분부터 감소하여 3시간 후에는 초기 농도와 같은 값인 40 mg/L으로 측정되었고, 1.0% NaCl을 첨가한 실험에서도 반응 초기에는 50 mg/L까지 증가하다가 60분부터 감소하여 3시간 후에는 초기 농도의 절반인 20 mg/L가 측정되었다. 1.0% NaCl을 첨가한 실험에서 유일하게 질산염이 50%가 제거되었다. 질산염은 전기분해 초기에 증가하다가 반응이 진행될수록 감소하기 시작하는데 첨가한 염소 이온 농도가 증가할수록 감소가 시작되는 시간이 빨라지는 것으로 보인다. Fig. 2에서 암모니아가 제거된 시간이 각각 180분, 120분, 90분인 것을 고려했을 때 반응 초기에 질산염이 증가하는 것은 암모니아의 질산염으로의 산화 영향으로 농도가 높아졌고, 이후 암모니아가 제거되면서 암모니아 농도가 감소함에 따라 산화되는 질산염의 양이 감소함과 동시에 음극에서 질산염이 재환원되면서 감소한 것으로 판단된다. 또한 NaCl을 추가한 두 실험에서 질산염의 증가가 NaCl을 추가하지 않은 실험의 증가와 비교했을 때 그 폭이 크지 않은 것으로 보아 용액 속 염소 이온이 증가할수록 암모니아가 질소 가스로 간접 산화되는 식 (7) ~ (10) 반응의 기여가 더 커서 식 (11)과 (12) 반응으로 생성되는 질산염의 양이 적은 것으로 추측된다.
염소 이온 농도의 증가가 질산염으로의 산화를 촉진시켜 질산성 질소의 제거율이 감소한다는 선행 연구[ 36]와는 달리 40 mg/L 정도의 비교적 저농도 질산염의 경우 3시간 전기분해 시 초기에 증가하다가 암모니아 감소 이후 감소가 시작되어 최대 50%까지 제거되었다. 이 선행연구가 500 mg/L 정도의 질산염을 사용한 실험이었음을 고려해볼 때, 암모니아와 질산염이 동시에 존재할 경우 저농도의 질산염은 염소 이온 존재 시 암모니아 산화 반응에 영향을 받아 3시간 이내에 제거되는 것으로 보인다.
Fig. 4에서 RuO 2/Ti 양극과 TiO 2 nanotube 음극 이용한 전기분해 시스템으로 폐수를 전기분해 하였을 때 염소 이온 농도에 따른 총질소의 변화를 확인할 수 있다. 모든 실험에서 총질소의 농도가 빠르게 감소하였고 총질소 제거율이 90% 이상으로 측정되었다. 전기분해 3시간 동안 No NaCl, 0.5% NaCl, 1.0% NaCl 순서대로 각각 92%, 95%, 99%까지 제거된 것으로 측정되었고 첨가한 염소 이온의 농도가 증가할수록 총질소 제거율 또한 증가하였다. 특히 1.0% NaCl을 추가한 실험에서는 암모니아가 완전히 제거된 것과 질산염의 50%가 제거된 영향으로 총질소 제거율이 가장 높은 것으로 나타났다. 총질소의 대부분인 암모니아가 빠르게 감소하여 완전히 제거된 영향으로 총질소 또한 빠른 시간 내에 제거된 것을 확인하였다.
3.3. 전류밀도에 따른 영향
Fig. 5에서 RuO 2/Ti 양극과 TiO 2 nanotube 음극 전기분해 시스템으로 폐수를 전기분해 하였을 때 전류밀도에 따른 암모니아의 농도 변화를 나타내었다. 전류밀도가 증가할수록 암모니아 제거율이 증가하는 것을 확인할 수 있다. 암모니아는 전기화학적 처리 3시간 이후에 전류밀도 20 mA/cm 2 실험에서 65%, 30 mA/cm 2 실험에서 90%, 40 mA/cm 2와 50 mA/cm 2 실험에서 99%가 제거된 것으로 측정되었다. 그 이상의 전류밀도인 60 mA/cm 2 실험에서는 120분에 완전히 제거되었고 70 mA/cm 2 실험에서는 90분에 완전히 제거되었다. 전류밀도가 증가할수록 양극 표면에서는 암모니아의 직접 산화 반응뿐만 아니라 수용액 속 염소 이온이 차아염소산으로 산화되는 반응과 차아염소산이 차아염소산 이온으로 산화되는 반응도 증가한다[ 44, 45]. 따라서 암모니아가 질소 가스로 직접 산화되어 제거되는 반응의 증가와 더불어 염소계 산화제 증가에 따른 간접 산화 반응이 증가하여 전류밀도가 증가할수록 암모니아가 제거되는 시간이 감소하는 것으로 판단된다.
Fig. 6에서 RuO 2/Ti 양극과 TiO 2 nanotube 음극 전기분해 시스템으로 폐수를 전기분해하였을 때 전류밀도에 따른 질산염 농도 결과를 나타내었다. 전기분해 시 전류밀도 20 ~ 40 mA/cm 2 실험에서는 초기 40 mg/L 정도인 질산염의 농도가 180분 후에 3배까지 증가하여 120 mg/L으로 측정되었다. 전류밀도 50 ~ 70 mA/cm 2 실험에서는 질산염이 더욱 빠르게 증가하여 90분만에 3배까지 측정되었고 순서대로 각각 120분, 90분, 90분부터 감소가 시작되었다. 전류밀도가 높을수록 질산염이 최대 농도까지 증가하는 시간이 빨라지는 것으로 보인다. 또, Fig. 5에서 확인한 것처럼 암모니아가 제거된 시점이 각각 180분, 120분, 90분인 것을 고려했을 때 암모니아의 제거 이후 질산염의 감소가 시작된 것으로 보인다. 질산염의 이러한 경향은 염소 이온 농도에 따른 실험의 질산염 농도 변화 경향과도 일치한다.
앞에서 언급한 것처럼 전기분해 3시간 동안 암모니아가 완전히 제거된 전류밀도 50 ~ 70 mA/cm 2 실험에서는 암모니아 제거 이후로 질산염의 감소가 시작된다. 전류밀도 50 mA/cm 2 실험에서는 120분에 133 mg/L에서 180분에 111 mg/L로 감소한 것으로 측정되었고, 전류밀도 60 mA/cm 2 실험에서는 90분에 106 mg/L에서 180분에 73 mg/L로 감소하였다. 150분까지만 실험을 진행한 70 mA/cm 2 실험에서는 90분에 113 mg/L에서 150분에 71 mg/L까지 감소하였다. 따라서 일단 질산염의 감소가 시작되면 그 속도는 전류밀도가 높을수록 빠른 것으로 보인다. Fig. 3에서 확인했듯이 염소 이온을 첨가한 실험에서는 질산염이 초기 농도보다 감소하여 최대 50%까지 제거된다. 그러나 염소 이온 추가없이 전기분해하는 경우 180분 이내에 질산염이 초기 농도보다 감소하지는 않았다. 이는 염소 이온을 추가하지 않은 폐수 속 염소 이온의 농도가 상대적으로 낮기 때문에 전기분해 시 암모니아 산화 반응 중 식 (11)과 (12)과 같은 질산염으로의 직접 산화 반응의 기여가 더 높은 것으로 추측되어, 그 영향으로 음극에서의 환원에 의한 질산염의 감소가 비교적 느리게 나타나는 것으로 보인다.
Fig. 7에서 RuO 2/Ti 양극과 TiO 2 nanotube 음극 전기분해 시스템으로 폐수를 전기분해하였을 때 전류밀도에 따른 총질소의 농도 변화를 확인할 수 있다. 모든 실험에서 초기 농도 2,600 mg/L인 총질소는 전기분해 3시간 동안 암모니아가 65% 제거된 20 mA/cm 2 실험에서 70%가 제거되었고, 암모니아가 90% 제거된 30 mA/cm 2 실험에서는 93%가 제거되었고, 암모니아가 완전히 제거된 40 ~ 60 mA/cm 2 실험에서는 각각 92%, 94%, 95%가 제거되었다. 70 mA/cm 2 실험에서는 전기분해 150분 후에 99%가 제거된 것으로 측정되었다. 전류밀도가 높아질수록 암모니아 제거가 촉진됨에 따라 총질소 제거율 또한 높아진 것을 확인할 수 있다. 염소 이온을 첨가한 실험에서와 마찬가지로 암모니아가 제거된 영향으로 총질소까지 제거되었다.
3.4. pH 변화
Fig. 8에서 RuO 2/Ti 양극과 TiO 2 nanotube 음극 전기분해 시스템으로 폐수를 3시간 동안 전기분해한 후, 각 조건별로 측정된 pH를 나타내었다. 초기 8.5였던 pH는 전기분해 후 모든 실험에서 pH 10 이상으로 증가하였고 최고 12까지 측정되었다. 암모니아는 pH 11 이상에서 질소 가스로 방출되기 때문에, pH 증가에 의한 탈기 또한 암모니아 감소에 영향을 미쳤을 것으로 사료된다.
암모니아가 제거된 시간이 빠른 실험일수록 pH가 높게 측정되었고, 암모니아가 완전히 제거된 실험에서 질산염 감소량이 높을수록 pH가 더 높았다. 전기분해가 진행될 때, 식 (7) ~ (10)처럼 암모니아 산화에 의한 수산화 이온의 소비가 이루어지고 식 (12)~ (17)처럼 질산염의 환원에 의해 수산화 이온이 발생한다. 따라서 산화에 의해 소비되는 수산화 이온의 영향보다 환원될 때 생성되는 수산화 이온의 영향이 더 크기 때문에 pH가 증가한 것으로 판단되며, 암모니아 간접 산화 시 수산화 라디칼에 의한 산화보다는 염소계 산화제(HOCl, OCl -)에 의한 산화가 더 우세한 것으로 판단된다.
4. 결 론
본 연구는 RuO2/Ti 양극과 TiO2 nanotube 음극을 사용하여 고농도 질소 폐수 속 암모니아 제거 가능성을 알아보고자 하였으며, 염소 이온 농도와 전류밀도를 조절하여 악취 제거 공정에서 발생하는 폐수 속 1,700 mg/L의 암모니아를 완전히 제거하였고 40 mg/L의 질산염을 최고 50%까지 제거하여 실제 공정에 적용 시 폐수 속 암모니아성 질소와 질산성 질소를 동시에 효율적으로 제거할 수 있음을 확인하였다.
1)RuO2/Ti 양극과 TiO2 nanotube 음극을 사용하여 고농도 질소 폐수 전기분해 시, 염소 이온 농도가 증가함에 따라 폐수 속 암모니아의 산화를 촉진시키는 결과가 나타났다. 이는 염소 이온의 추가로 인해 증가한 염소계 산화제가 암모니아의 간접산화를 촉진시킨 결과라 판단되며, 총질소 또한 염소이온 증가 시 제거율이 증가하였다. 전기화학적 산화・환원을 이용한 암모니아 질소 제거 시, 질산염의 증가 없이 암모니아를 제거하기 위해서는 염소 이온의 산화 반응에 의한 간접 산화 효과와 TiO2 nanotube 음극에 의한 환원 반응의 상승으로 인해 총질소 제거효율을 높일 수 있었다고 판단된다. 따라서 전기화학적 산화・환원을 통해 고농도 질소 폐수 처리 시 TiO2 nanotube 음극과 염소 이온의 첨가를 통해 효율을 증가시킬 수 있을 것이라 판단된다.
2)전류밀도에 따른 고농도 질소 폐수 전기화학적 산화・환원 진행에서 전류밀도의 증가로 인해 폐수 속 암모니아 제거 효율이 증가하는 것으로 나타났다. 전류밀도 증가에 따라 질산염 농도 감소율 또한 높아지는 것을 알 수 있었으며, 이는 TiO2 nanotube 음극에서의 환원 반응의 속도 증가에 따른 결과라고 판단된다.
3)고농도 질소를 함유하는 폐수를 전기화학적 산화・환원을 이용하여 처리시 낮은 전류밀도와 짧은 반응시간 내에 높은 처리 효율을 얻은 이유는 TiO2 nanotube 음극의 높은 환원 반응성에 의한 결과라고 판단되며 음극에서의 환원 반응 속도의 증가는 질산염 제거 반응을 촉진시킨 결과로 사료된다. 따라서 전기화학적 산화・환원 반응을 이용하여 암모니아 제거 시 TiO2 nanotube를 음극으로 사용하면 보다 높은 효율을 나타낼 것으로 보인다.
Acknowledgments
본 연구는 서울과학기술대학교의 지원을 받아 수행되었습니다. 이에 감사드립니다.
Fig. 1.
Set-up of electrochemical reactor with DC power supply. 
Fig. 2.
Oxidation of NH3 depending on the Cl- concentration during the electrochemical treatment with RuO2/Ti anode and TiO2 nanotube cathode (Current density: 40 mA/cm2, Applied voltage: 3.9 V ~ 4.7 V). 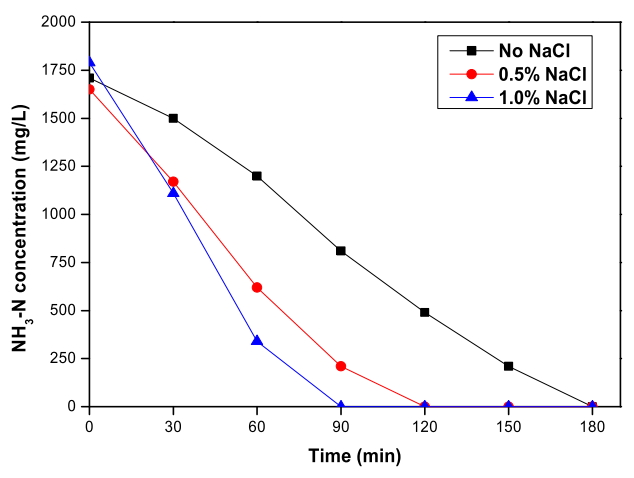
Fig. 3.
Production of nitrate depending on the Cl- concentration during the electrochemical treatment with RuO2/Ti anode and TiO2 nanotube cathode (Current density: 40 mA/cm2, Applied voltage: 3.9 V ~ 4.7 V). 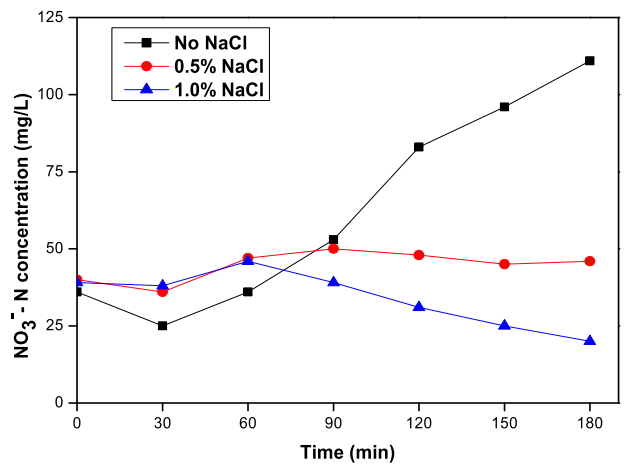
Fig. 4.
Total nitrogen removal depending on the Cl- concentration during the electrochemical treatment with RuO2/Ti anode and TiO2 nanotube cathode (Current density: 40 mA/cm2, Applied voltage: 3.9 V ~ 4.7 V). 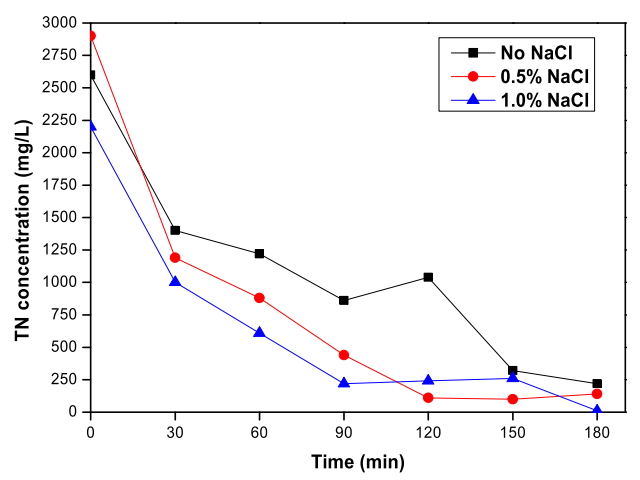
Fig. 5.
Variation of ammonia concentration depending on the current density during the electrochemical treatment with RuO2/Ti anode and TiO2 nanotube cathode (Cl- concentration : 2,600 mg/L, Applied voltage : 3.5 V ~ 4.8 V). 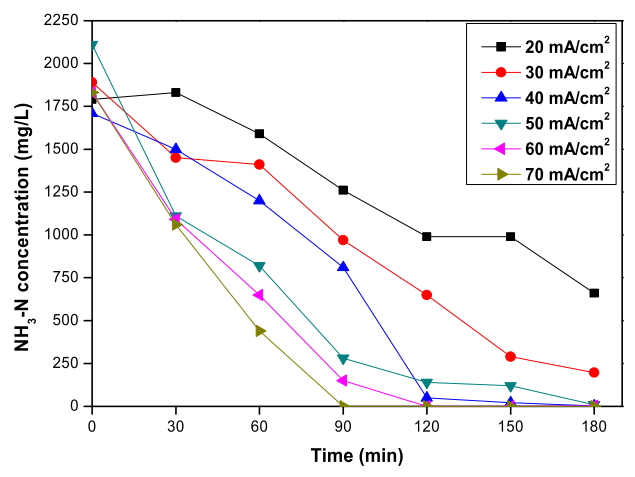
Fig. 6.
Variation of nitrate concentration depending on the current density during the electrochemical treatment with RuO2/Ti anode and TiO2 nanotube cathode (Cl- concentration : 2,600 mg/L, Applied voltage : 3.5 V ~ 4.8 V). 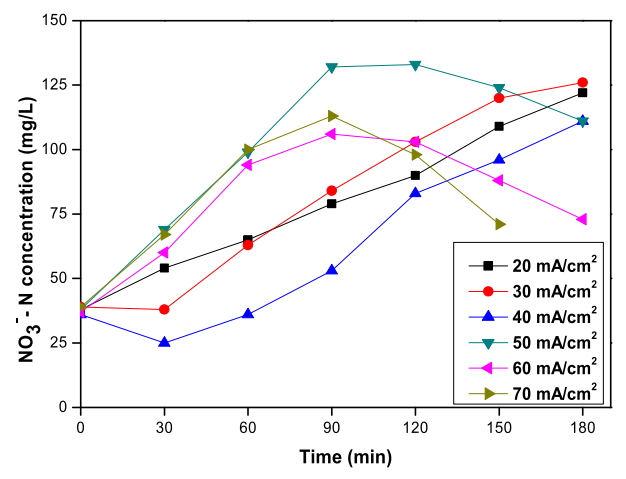
Fig. 7.
Variation of total nitrogen concentration depending on the current density during the electrochemical treatment with RuO2/Ti anode and TiO2 nanotube cathode (Cl- concentration : 2,600 mg/L, Applied voltage : 3.5 V ~ 4.8 V). 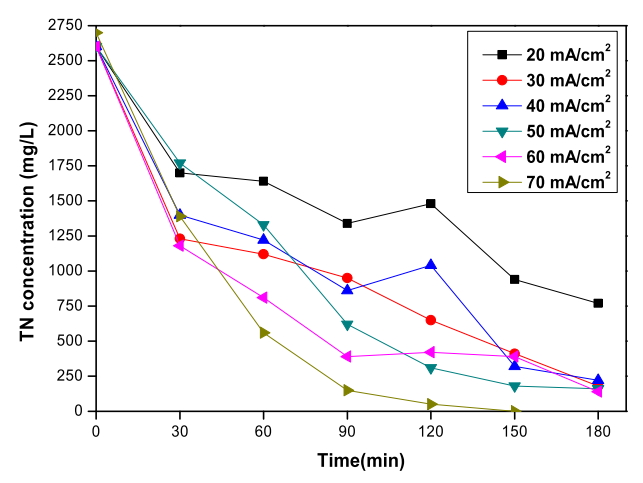
Fig. 8.
After 3 h of the electrochemical treatment with RuO2/Ti anode and TiO2 nanotube cathode, pH of each electrolysis. 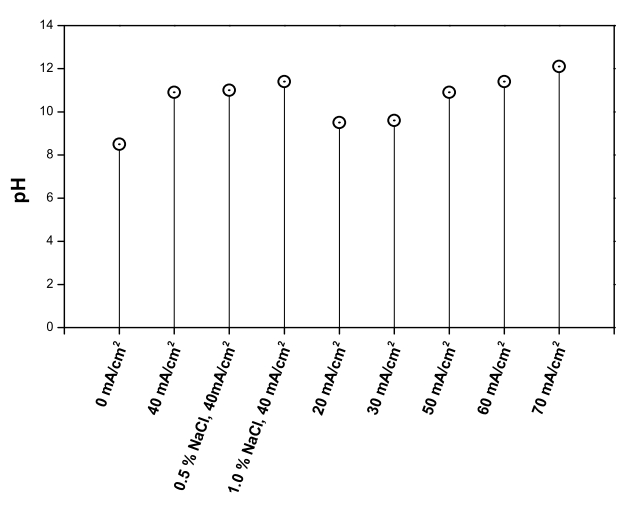
Table 1.
Electrochemical treatment of ammonia found in the literature.
|
Author |
Electrode
|
Currnet density
|
Cl- concentration
|
Ammonia concentration
|
Removal efficiency
|
Reaction time
|
Reference |
|
anode |
cathode |
mA/cm2
|
mg/L |
mg/L |
% |
h |
|
Kim (2006) |
IrO2/Ti |
Ti |
80 |
0 |
1,400 |
34 |
1.5 |
[38] |
|
35,450 |
1,400 |
41 |
1.5 |
|
Liu (2009) |
IrO2/Ti |
Stainless steel |
15.4 |
300 |
103 |
95 |
8 |
[39] |
|
Hu (2009) |
RuO2/Ti-Pt |
Ti |
30 |
3,034 |
40 |
40 |
1 |
[40] |
|
Wang (2012) |
RuO2/Ti |
Cu |
30 |
607 |
100 |
100 |
3 |
[41] |
|
Shin (2019) |
Zn |
Zn |
23.8 |
1,000 |
1,386 |
95 |
24 |
[30] |
Table 2.
|
Value |
|
pH |
8.5 |
|
Cl- (mg/L) |
2,600 |
|
NH3-N (mg/L) |
1,710 ~ 2,100 |
|
NO3--N (mg/L) |
36 ~ 40 |
|
TN (mg/L) |
2,100 ~ 2,600 |
Table 3.
Composition of wastewater.
|
Component |
Concentration (mg/L) |
|
Co |
0.002 |
|
Ni |
0.095 |
|
Cu |
0.366 |
|
Zn |
0.319 |
|
Ag |
0 |
|
Cd |
0 |
|
Pb |
0.008 |
|
Al |
0.621 |
|
P |
0.321 |
|
K |
3.857 |
|
Ca |
1.629 |
|
Cr |
0.097 |
|
Mn |
0.015 |
|
Fe |
0.334 |
References
1. M. R. Burkart, J. D. Stoner, Nitrate in aquifers beneath agricultural systems, Water Sci. Technol., 56(1), 59-69(2007).  2. S. Garcia-Segura, M. Lanzarini-Lopes, K. Hristovski, P. Westerhoff, Electrocatalytic reduction of nitrate: fundamentals to full-scale water treatment applications, Applied Catalysis B: Environmental, 236, 546-568(2018).  3. B. J. Lee, S. H. Cho, Removal of ammonia-nitrogen contained in landfill leachate by ammonia stripping(I), J. Korean Soc. Environ. Eng., 22(10), 1893-1904(2000).
4. S. Y. Shin, B. H. Koo, T. H. Kim, Y. H. Lee, J. H. Ahn, Ammonia nitrogen removal in wastewater using microwave irradiation, J. Korean Soc. Water Environ., 30(5), 486-490(2014).  5. S. H. Jang, G. E. Kim, H. M. Shin, Y. C. Song, W. K. Lee, Y. N. Youn, Study on removal of ammonia nitrogen from metal working fluids using aluminum electrode, J. Korea Soc. Waste Manag., 33(7), 710-715(2016).  6. S. K. Bae, S. C. Park, The study on the removal of ammonia in wastewater by electrochemical method, J. Korean Soc. Environ. Eng., 6(1), 44-55(1984).
7. E. J. Bouwer, P. B. Crowe, Biological process in drinking water treatment, J. Am. Water Works Ass., 80(9), 82-93(1988).  8. C. J. Houtman, Emerging contaminants in surface waters and their relevance for the production of drinking water in Europe, J. Integr. Environ. Sci., 7(4), 271-295(2010).  9. M. Li, C. Feng, Z. Zhang, N. Sugiura, Efficient electrochemical reduction of nitrate to nitrogen using Ti/IrO 2-Pt anode and different cathodes, Electrochimica Acta, 54(20), 4600-4606(2009).  10. H. L. Li, J. Q. Chambers, D. T. Hobbs, Electroreduction of nitrate ions in concentrated sodium hydroxide solutions at lead, zinc, nickel and phthalocyanine-modified electrodes, J. Appl. Electrochem., 18, 454-458(1988).  11. D. Reyter, D. Bélanger, L. Roué, Study of the electroreduction of nitrate on copper in alkaline solution, Electrochim. Acta, 53(20), 5977-5984(2008).  12. A. C. A. de Vooys, R. A. van Santen, J. A. R. van Veen, Electrocatalytic reduction of NO3− on palladium/copper electrodes, J. Mol. Catal. A: Chem., 154(1-2), 203-215(2000).  13. M. S. El-Deab, Electrochemical reduction of nitrate to ammonia at modified gold electrodes, Electrochim. Acta, 49(9-10), 1639-1645(2004).  14. C. R. Shin, Effect of chlorine residual generation and nitrate removal by electrolysis, Master’s Thesis, Kookmin University, Korea(2008).
15. Y. Deng, J. D. Englehardt, Electrochemical oxidation for landfill leachate treatment, Waste Manag., 27(3), 380-388(2007).  16. M. L. Bosko, M. A. S. Rodrigues, J. Z. Ferreira, E. E. Miró, A. M. Bernardes, Nitrate reduction of brines from water desalination plants by membrane electrolysis, J. Membr. Sci., 451, 276-284(2014).  17. H. G. Oswin, M. Salomon, The anodic oxidation of ammonia at platinum black electrodes in aqueous KOH electrolyte, Can. J. Chem., 41(7), 1686-1694(1963).  18. N. J. Bunce, D. Bejan, Mechanism of electrochemical oxidation of ammonia, Electrochim. Acta, 56(24), 8085-8093(2011).  19. C. E. Adams, Removing nitrogen from waste water, Environ. Sci. Technol., 7(8), 696-701(1973).  20. C. T. Jafvert, R. L. Valentine, Reaction scheme for the chlorination of ammoniacal water, Environ. Sci. Technol., 26(3), 577-586(1992).  21. G. C. White, The Handbook of Chlorination, 2nd ed., Van Nostrand,, New York, USA(1986).
22. A. G. Vlyssides, C. J. Israilides, Detoxification of tannery waste liquors with an electrolysis system, Environ. Pollut., 97(1-2), 147-152(1997).  23. C. P. Poon, T. G. Brueckner, Physicochemical treatment of wastewater-seawater mixture by electrolysis, J. - Water Pollut. Control Fed., 47(1), 66-78(1975).
24. A. G. Vlyssides, P. K. Karlis, N. Rori, A. A. Zorpas, Electrochemical treatment in relation to pH of domestic wastewater using Ti/Pt electrodes, J. Hazard. Mater., 95(1-2), 215-226(2002).  25. K. V. Hege, M. Verhaege, W. Verstraete, Electro-oxidative abatement of low-salinity reverse osmosis membrane concentrates, Water Res., 38(6), 1550-1558(2004).  26. Y. Zhang, J. Li, J. Bai, L. Li, S. Chen, T. Zhou, J. Wang, Li. Xia, Q. Xu, B. Zhou, Extremely efficient decomposition of ammonia N to N2 Using ClO∙ from reactions of HO∙ and HOCl fenerated in situ on a novel bifacial photoelectroanode, Environ. Sci. Technol., 53(12), 6945-6953(2019).  27. K. W. Kim, Y. J. Kim, I. T. Kim, G. I. Park, E. H. Lee, The electrolytic decomposition mechanism of ammonia to nitrogen at an IrO 2 anode, Electrochim. Acta, 50(22), 4356-4364(2005).  28. L. Marinčić, F. B. Leitz, Electro-oxidation of ammonia in waste water, J. Appl. Electrochem., 8, 333-345(1978).  29. K. Bouzek, M. Paidar, A. Sadílková, H. Bergmann, Electrochemical reduction of nitrate in weakly alkaline solutions, J. Appl. Electrochem., 31(11), 1185-1193(2001).  30. J. H. Shin, Removal of nitrogen compounds in wastewater through electrolysis, Master’s Thesis, Yonsei University, Korea(2019).
31. L. Szpyrkowicz, S. Daniele, M. Radaelli, S. Specchia, Removal of NO3- from water by electrochemical reduction in different reactor configurations, Appl. Catal., B, 66(1-2), 40-50(2006).
32. M. Paidar, I. Rousar, K. Bouzek, Electrochemical removal of nitrate ions in waste solutions after regeneration of ion exchange columns, J. Appl. Electrochem., 29, 611-617(1999).  33. V. Krstić, B. Pešovski, Reviews the research on some dimensionally stable anodes (DSA) based on titanium, Hydrometallurgy, 185, 71-75(2019).  34. J. Kim, C. Kim, S. Kim, J. Yoon, A review of chlorine evolution mechanism on dimensionally stable anode (DSA®), Korean Chem. Eng. Res., 53(5), 531-539(2015).  35. J. C. Lee, Development of energy saving DSA and electrochemical sensor for water treatment, Doctor’s Thesis, Seoul National University of Science and Technology, Korea(2014).
36. D. E. Kim, Y. H. Lee, H. Y. Choi, H. J. Han, D. W. Pak, The evaluation of electrolytic nitrate removal efficiency of TiO2 nanotube plate, Journal of the Korean Applied Science and Technology, 35(3), 612-621(2018).
37. H. O. N. Tugaoen, S. Garcia-Segura, K. Hristovski, P. Westerhoff, Compact light-emitting diode optical fiber immobilized TiO 2 reactor for photocatalytic water treatment, Sci. Total Environ., 613-614, 1331-1338(2018).  38. K. W. Kim, Y. J. Kim, I. T. Kim, G. I. Park, E. H. Lee, Electrochemical conversion characteristics of ammonia to nitrogen, Water Res., 40(7), 1431-1441(2006).  39. Y. Liu, L. Li, R. Goel, Kinetic study of electrolytic ammonia removal using Ti/IrO 2 as anode under different experimental conditions, J. Hazard. Mater., 167(1-3), 959-965(2009).  40. W. W. Hu, B. Bong, C. P. Feng, Electrochemical oxidation of ammonia-containing wastewater using Ti/RuO2-Pt electrode, Water Sci. Eng., 2(4), 103-109(2009).
41. Y. Wang, X. Guo, J. Li, Y. Yang, Z. Lei, Z. Zhang, Efficient electrochemical removal of ammonia with various cathodes and Ti/RuO 2-Pt anode, Open J. Appl. Sci., 2, 241-247(2012).  42. D. E. Kim, Development of TiO2 nanotube plate for efficient electrochemical nitrate reduction in wastewater, Doctor’s Thesis, Seoul National University of Science and Technology, Korea(2019).
43. J. C. Lee, D. W. Pak, Generation of free chlorine using RuO 2/Ti electrode with various amount of Ru, J. Korean Soc. Environ. Eng., 34(11), 715-719(2012).  44. M. K. Lee, Y. C. Kim, J. H. Park, G. C. Cha, Removal of organics and ammonia nitrogen from tannery wastewater by electrochemical oxidation process, J. Korean Soc. Water Environ., 16(1), 101-110(2000).
45. S. B. Lee, A study of free chlorine formation and ammonia nitrogen removal using electro-oxidation, Master’s Thesis, Seoul National University, Korea(2012).
|
|


















