|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractObjectivesPrior to the application of the developed TiO2-embedded expanded polystyrene balls (TiEPS balls) to water surface of rivers/lakes, the feasibility of TiEPS balls to prevent harmful algal blooms and to sustain the algal growth inhibition was evaluated. Thus, the changes in cell morphology and number, chlorophyll-a (Chl-a), specific growth rate (µ) and first order decay constant (k) of Microcystis aeruginosa (M. aeruginosa) were investigated through various indoor and outdoor growth inhibition experiments using TiEPS balls.
MethodsTiO2-embedded expanded polystyrene balls (TiEPS balls) were developed by using an cost-effective and practical immobilization method to attach/embed the nanoscale TiO2 particles on the surface of low-cost and thermally-deformable expanded polystyrene (EPS) buoyant, and were massively produced. The experiment was conducted indoors by irradiating the UV-C lamp, and outdoors under natural sunlight using reaction tanks [30 (H) × 20 (W) × 20 (L) cm] after inoculating the target initial numbers of pure cultures of M. aeruginosa.
Results and DiscussionBased on the results of cell morphology analysis, the cell solution was eluted out of the cell and the shape of the cell membrane was unevenly disrupted due to the attack of hydroxy radical (OH・) and super oxide anion (O2-) during the indoor and outdoor experiments using TiEPS balls. As a result of cell number and chlorophyll-a (Chl-a) analysis, algal growth was sustainably inhibited by applying TiEPS balls, and was mainly attributted to the photocatalytic degradation in the early stages of application, and synergistic effects from photocatalytic degradation and shading over the long term. Based on the analysis of specific growth rate (µ) and first order decay constant (k), greater degradation rate compared to growth rate for C (UV + TiEPS balls) was observed, and the effect of algae growth inhibition significantly increased as the shading area in water surface using TiEPS balls for outdoor experiments increased. Microcystin-LR and RR analysis revealed that microcystin was removed below the detection limit in all experimental groups, indicating that photocatalytic degradation using TiEPS balls degraded toxic substances eluted from the cell membrane disruption.
요약목적개발된 TiO2-embedded expanded polystyrene balls을 하천/호수의 수면에 현장적용 전에 Microcystis aeruginosa (M. aeruginosa)의 성장 억제(growth inhibition) 효과를 다양한 조건이 적용된 실내・외 실험을 통해 적용 타당성을 검증하였다. 따라서, 셀 형태(cell morphology), 셀 개체수(cell number)와 chlorophyll-a (Chl-a), 비성장속도(µ)와 일차분해속도상수(k), microcystin-LR, RR의 변화를 비교・분석하여 TiEPS balls이 조류발생을 사전예방하고 지속가능하게 조류증식을 예방할 수 있는지에 대해 검증하였다.
방법저비용이고 열적변형이 뛰어난 발포성 폴리스틸렌(expanded polystyrene, EPS) 소재의 수면 부유 지지체에 나노크기 TiO2 입자를 부착/내재시킬 수 있는 경제적이고 실용적인 TiO2-embedded EPS balls (TiEPS balls) 고정화공법을 개발해 TiEPS balls을 대량생산하였다. 실내실험은 UV-C 조사하에 실외실험은 옥외의 자연광 하에서 진행되었으며, 적용된 반응조는 30 (H)×20 (W)×20 (L) cm 크기의 차광된 아크릴 반응조(acrylic reactor)를 사용하였으며, 설정된 초기 셀 개체수(initial cell number)의 단일 배양된 M. aeruginosa를 접종하여 진행하였다.
결과 및 토의셀 형태(cell morphology) 분석결과, 실내・외 실험 중 TiEPS balls을 적용한 시험군 모두 세포 밖으로 세포액이 용출되고 세포막의 형태가 불균일하게 파괴되는 형태를 나타내었으며, 이러한 결과는 세포막의 일부가 하이드록시 라디칼(OH・)과 슈퍼 옥사이드 음이온(O2-)의 공격으로 인해 일부 분해되어 내부기관이 용출된 것으로 판단된다. 셀 개체수(cell number)와 chlorophyll-a (Chl-a)의 분석결과, 실내・외 실험 결과 TiEPS balls을 적용 시 지속적으로 조류성장을 억제하였으며, 이러한 조류의 증식억제는 TiEPS balls 적용 초기에는 광분해, 장기적으로 광분해와 차광에 의한 상승효과가 주된 조류성장 억제 요인으로 판단된다. 비성장속도(µ)과 일차분해속도상수(k)의 분석결과, 실내・외 실험에서 성장률 대비 높은 분해율을 나타냈으며, 실외실험의 경우 TiEPS balls의 수면적 도포비율 증가에 따라 조류성장 억제효과가 크게 증대되는 것으로 조사되었다. microcystin-LR, RR 분석 결과, 대조군 제외 모든 실험군에서 형태와 무관하게 microcystin이 검출한계 미만으로 제거되며, TiEPS balls을 활용한 광촉매 분해로 인해 M. aeruginosa의 증식저해 및 세포막 파괴로부터 용출되는 독성물질 또한 분해되는 것으로 확인되었다.
1. 서 론수중에 서식하는 조류(algae)는 수생태계의 1차 생산자로서 대기 중 2/3 이상의 산소를 공급하고, 유기물 생산을 통해 수중의 먹이망구축과 수생태계의 평형을 위한 필수불가결한 근간이 되는 중요한 생물이다[1~4]. 최근 우리나라는 기후변화(climate change)로 인한 수온의 상승과 강우패턴의 변화와 도시화 및 산업화로 인해 담수 자정능력을 초과하는 과도한 영양염류[질소(N)와 인(P)]의 지속적 수계 유입과 수계 내 설치된 다양한 하천횡단구조물로 인한 수리학적 체류시간(hydraulic retention time) 증대로 주요 하천 및 호소 등에 연중 조류가 과다 증식하여 녹조현상(green tide)이 지속적으로 발생하고 있다[4~10]. 이러한 녹조현상의 연중 지속으로 인해 수계 내 탁도 증가, 산소 고갈 및 침전물 형성 등 수생태계 내 생물서식 환경 악화와 특정 조류종에 의해 유발되는 독성물질과 이취미 물질로 인해 정수처리비용 증가 등의 문제가 발생하고 있다[4,8~10]. 국내에 서식하고 있는 담수조류(freshwater algae)는 대부분 미세한 크기의 부유성 미세조류로서, 환경부에서는 독성물질을 배출하는 유해 남조류(harmful algaes, HAs) 중 Microcystis, Anabaena, Ocillatoria, Aphanizomenon 4종을 지정하여 관리하고 있으며[11,12], 특별히 Microcystis는 담수에 존재하고 있는 cyanobacteria (blue-green algae)로서 간독소를 유발하는 마이크로시스틴(Microcystin)과 흙냄새를 유발하는 지오스민(Geosmin)을 발생하는 것으로 보고되고 있다[3~10].
기존의 많은 선행 연구를 통해 조류의 성장에 영향을 미치는 주요한 인자로는 수온(water temperature), 광량(light intensity), 영양염류(nutrients), 유속(water velocity), 성층화(stratification) 등의 요인이 복합적으로 결합된 것으로 조사되었으며, 수자원의 효용성 증대 및 수질악화를 저감시키기 위해 조류발생의 근간이 되는 원인물질 처리를 통한 사전예방 공법, 조류발생 이후에 녹조제거 및 회수를 통한 다양한 물리적, 화학적, 생물학적, 복합적 사후처리 공법 등이 지속적으로 개발되고 있다[12~14].
하지만 조류성장은 매우 다양한 환경요인(environmental factors)의 복잡한 상호작용에 기인하며[1~10], 수문과 기후, 호수 유역 및 형상, 물리적, 화학적 및 생물학적 요인에 따라 조류의 증식과 대량 발생이 결정되기 때문에 발생현장에 적합한 맞춤형(site-specific) 조류저감기술의 도입이 필요한 것으로 판단된다. 그러나 국내에서 개발된 대부분의 조류저감기술들은 일시적/부분적으로 조류저감 및 제거효과를 거둘 수 있으나 장기간 지속가능(sustainable)하지 않다는 단점이 있으며, 다양한 환경요인과 그에 따른 소요 비용 및 수생태계에 관한 영향을 종합적으로 고려한 현장 맞춤형 적용 가능한 기술은 매우 제한적이다. 따라서 저비용의 지속가능하며, 조류증식 억제 효율이 우수하고, 수생태계에 직・간접적 위해가 없는 유지관리가 불필요한 조류성장 예방 공법이 필요한 실정이다[12~16].
일반적으로 광촉매반응은 TiO2, ZnO 등의 광촉매에 밴드 갭(band gap)이상의 에너지가 조사 시 발생된 전자(e-)와 정공(h+)이 광촉매 표면에 접촉된 물, 산소, 수산화 이온, 수소이온 등과의 반응을 통해 hydroxy radical (OH+)과 superoxide anion (O2-) 등의 활성산소를 생성한다[17,18]. 생성된 활성산소는 염소나 오존보다 높은 산화력을 통해 다양한 유기오염물을 효과적으로 분해할 수 있는 것으로 보고되고 있다[19,20]. 광촉매는 반영구적인 활성, 태양에너지의 활용 가능, 기상 및 액상의 계면에서 유기오염물의 이산화탄소(CO2)와 물(H2O)로의 효과적인 분해 등의 장점과 경제적이고 친환경적인 정화소재로서 다양한 수질정화분야에서 널리 적용되고 있다[17~20]. 그 중에서 이산화티타늄(TiO2)의 경우 비교적 좁은 밴드 갭을 가지고 있는 산화물 반도체로서, 물리・화학적으로 매우 안정적이고 수용체에 무독성인 것으로 보고되고 있어 널리 활용되고 있다[21~23].
광촉매의 장점을 활용해 수중의 유기오염물 저감 및 유해 남조류(HAs)의 증식억제를 위해 조류가 과다 번성된 우심지역의 조류저감을 목적으로 광촉매가 부착/내재된 부유체를 활용한 다양한 선행연구가 진행되고 있다[24~28]. 비록 고정화된 광촉매 입자는 반응 표면적이 슬러리 형태로 액상에 분산된 광촉매 입자 대비 감소되는 단점을 가지고 있으나, 적용 현장에서 회수가 불필요하고 지속적 활용이 가능하여 경제적이고 유지관리가 불필요한 조류증식 사전 억제공법으로 판단된다.
따라서 본 연구에서는 저비용이고 열적변형이 뛰어난 발포성 폴리스틸렌(expanded polystyrene, EPS) 소재의 수면 부유 지지체에 나노크기 TiO2 입자를 부착/내재시킬 수 있는 경제적이고 실용적인 TiO2-embedded EPS balls (TiEPS balls) 고정화(embedding) 공법을 개발하여 TiEPS balls을 대량 생산하여 실험실 규모 실험에 사용하였다. 또한, 개발된 TiEPS balls을 적용하여 남조류인 Microcystis aeruginosa (M. aeruginosa)의 성장저해효과(growth inhibition effect)를 다양한 실험조건으로 실험실 규모 실내・외 실험을 통해서 검증하는 것을 주요 목적으로 설정하였다. 본 연구의 주요 세부 목적은 TiEPS balls의 다양한 수면적 도포비율에 따른 (1) M. aeruginosa의 셀 개체수(cell number)와 셀 형태(morphology) 변화 조사, (2) chlorophyll-a (Chl-a) 농도변화 조사, (3) M. aeruginosa의 성장률(growth rate, µ) 및 일차 분해율(first order decay constant, k)의 산출 및 (4) microcystin-LR, RR의 농도변화 조사 등이다. 본 연구결과를 통해 개발된 TiEPS balls을 하천 및 호수의 수면에 현장적용 전 조류발생을 사전예방하고 지속가능하게 조류증식을 예방할 수 있는지 실험실 규모 실내・외 실험을 통해서 선행적으로 평가하였다.
2. 재료 및 방법2.1. TiO2-embedded EPS balls (TiEPS balls) 제조TiO2-embedded EPS (TiEPS) balls 제조에 사용된 TiO2는 Rutile:Anatase 비율이 85:15인 P25 (Evonik Degussa, Germany) 상업용을 구매하여 사용하였으며, 분산제인 Glycerin 용매(Daesung Chemicals & Metals Co., Korea)는 순도 99%의 GR등급을 구매하여 활용하였고, 지지체인 직경 3 cm 크기의 EPS balls (Daehyun Co.)은 비드법 1종으로 구매하여 복합체인 TiEPS balls의 대량 제조에 활용하였다.
본 실험에 사용한 TiEPS balls은 나노 크기의 TiO2 (P25) 입자를 균질하게 분산시킨 TiO2/Glycerin 용액을 EPS balls 고분자 표면의 열적 변형이 발생하는 온도인 130~140℃로 가열하였다. 직경 3 cm 크기의 EPS balls을 가열된 TiO2/Glycerin 용액에 반복적으로 침지(immersion)시켜 EPS balls 표면의 개별 비드와 비드 간 공극과 균열의 발달로 비표면적(specific surface area)이 크게 증대되어 TiO2 입자의 부착(attachment) 및 내재(embedding)를 증가시켰다. EPS balls 표면에 TiO2 입자를 표면에 고르게 부착/내재시킨 후, 1~4℃ 얼음물에 침지시켜, 표면을 급속 냉각 후 자연 건조하여 암실에서 보관 후 사용하였다[26,29,30].
2.2. Microcystis aeruginosa 배양 방법본 실험에 사용된 남조류 Microcystis aeruginosa (M. aeruginosa)는 W 저수지로부터 채수하여 실험실에서 동정 분리하였다. 모든 배양실험은 표면적 175 cm2, 부피 50 mL의 SPL사(Korea)의 Cell Culture 플라스크에 pH 9로 조정한 CB 배지에 M. aeruginosa를 일정량 접종하여 배양하였다. 배양조건은 28±1℃, 12 µmol-photons m-2s-1, 1일 간격으로 명암주기(12시간 light/dark cycle)가 자동 조절되는 shaking incubator에서 28±1 rpm으로 18일간 배양하여 실험에 사용하였다. M. aeruginosa의 배양에 사용된 CB 배지의 구체적인 조성은 Table 1에 나타내었다[31].
2.3. 실험실 규모 실내 실험(Lab-scale Indoor experiment)남조류 M. aeruginosa에 대한 TiO2 부착 유무 및 TiEPS balls의 적용 유무에 따른 조류성장 억제효과를 비교・분석하기 위해 A) 대조군(Control), B) UV만 적용, C) UV+TiEPS balls의 수면적 도포비율 100%, D) UV+EPS balls의 수면적 도포비율 100%의 조건을 적용하였다. 또한 대조군을 제외한 3개의 반응조에 UV-C lamp (200~280 nm)를 조사(irradiation)하여 실내에서 실험을 진행하였으며, 반응조는 30 (H)×20 (W)×20 (L) cm 크기의 차광된 아크릴 반응조(acrylic reactor)를 사용하여 5일간 실험을 진행하였다.
초기 셀 개체수(initial cell number)가 1×106 cells/mL인 단일 배양된 M. aeruginosa를 적용한 시료 4 L를 각 반응조에 주입 후 실험을 진행하였다. 각 반응조는 외부의 요인을 차단한 상태로 공기가 유입되는 조건에서 진행되었으며, UV-C를 조사한 상태에서의 광량은 584 Wm-2, 평균 수온은 19.9℃의 조건에서 진행하였다. 또한 TiEPS balls의 적용에 따른 세포파괴에 의한 독소 용출 여부를 검증하기 위해 실험 초기와 종료 시점에 microcystin-LR, RR (MC-LR, RR)의 농도를 분석하였다(Fig. 1(a) 참조).
2.4. 실험실 규모 실외실험(Lab-scale Outdoor experiment)TiEPS balls을 활용해 남조류 M. aeruginosa 성장 억제효과를 검증하기 위해 TiO2 부착 유무 및 TiEPS balls의 수면적 도포 비율을 조정하여 조류성장 억제효과를 비교・분석하였다. 실험조건은 A) 대조군(Control), B) TiEPS balls의 수면적 도포비율 50%, C) TiEPS balls의 수면적 도포비율 100%, D) EPS balls의 수면적 도포비율 100%의 조건을 적용하였다. 실외실험은 옥외의 자연광 하에서 진행되었으며, 적용된 반응조는 30 (H)×20 (W)×20 (L) cm 크기의 차광된 아크릴 반응조(acrylic reactor)를 사용하여 10일간 진행하였다. 초기 셀 개체수(initial cell number)는 5.75×106 cells/mL의 단일 배양된 M. aeruginosa를 적용하였으며, 시료 6 L를 각 반응조에 주입 후 실험을 진행하였다. 각 반응조는 외부의 요인과 공기가 유입되며, 실험기간 동안 평균 일사량 284 Wm-2, 평균 수온 26.5℃의 조건에서 진행하였다(Fig. 1(b) 참조).
2.5. 분석 방법조류성장 억제 효과를 관측하기 위한 셀 개체수(cell number)분석과 조류성장 억제 기작 분석을 위한 형태(morphology)분석은 시료 채취 즉시 루골용액을 이용해 셀 고정 및 암실에 보관 후 실험실 내의 광학현미경(DN-10A, Samwon Scientific Industries, Ltd., Korea)과 혈구계수기(Marienfeld, Germany)를 사용하여 분석하였다.
수중의 식물 플랑크톤 세포에 다량 및 보편적으로 분포하고 있는 chlorophyll-a (Chl-a) 농도의 측정을 위해 각 시료 200 mL를 0.45-µm GF/C filter (Whatman, UK)를 이용하여 여과한 다음, 여과지와 90% 아세톤 적당량(5 mL~10 mL)을 조직마쇄기에 함께 넣고 마쇄하였다. 마쇄한 시료를 마개 있는 원심 분리관에 넣고 밀봉하여 4℃ 암실에서 24시간 보관 후 색소를 추출한 후, 색소 추출 시료를 500 G의 원심력으로 20분간 원심 분리하여 원심 분리한 시료의 상등액을 적당량 취하여 10 mm 흡수셀에 옮겨 각각의 시료를 665 nm, 750 nm에서 흡광도를 측정한 후, Chl-a의 농도는 아래의 식 (1)을 이용하여 산출하였다[32].
A는 Chl-a의 흡수계수(11.0), K는 초기 엽록소 농도에 대한 흡수성의 감소 보정값(2.43), 6650는 산성화 전 흡광도, 665a는 산성화 후 흡광도, υ는 엽록소 추출에 사용된 아세톤의 용량(mL), Vf는 여과한 총량(mL), 그리고 l은 흡광도 셀의 길이(cm)를 나타낸다.
M. aeruginosa의 비성장속도(growth rate)와 일차분해속도(first order decay)는 시간 경과에 따른 셀 개체수 변화율을 조사하여 아래의 식 (2)와 (3)을 이용하여 산출하였다.
µ는 비성장속도 상수(day-1), k는 일차분해속도 상수(day-1), N0 및 Nt는 초기 및 일정 경과 시간 후의 M. aeruginosa 개체수(cells/mL), 그리고 t는 경과 시간(day)을 나타낸다.
3. 결과 및 고찰3.1. 셀 개체수(cell number)와 형태(morphology) 변화셀 개체수(cell number) 분석 결과, 실험실 규모의 실내/외 실험 중 대조군 A (Control)의 셀 개체수가 지속적으로 성장 혹은 유지되어 M. aeruginosa의 성장저해(growth inhibition) 현상은 관측되지 않아 대조군 실험조건에서 주요한 성장저해 요인은 없는 것으로 판단되었다. 실내의 TiEPS balls의 적용 유무에 따른 조류성장 억제효과를 비교(Fig. 2(a_B vs C))한 결과, TiEPS balls이 적용되지 않은 B (UV only)의 경우 10시간 이후부터 셀 개체수의 감소가 명확히 관측되며, UV에 의한 M. aeruginosa의 성장 저해 및 사멸이 확인되었다. TiEPS balls이 적용된 Fig. 2(a_C) (UV+TiEPS balls)의 경우 M. aeruginosa의 성장저해가 관측되나, EPS balls이 적용된 Fig. 2(a_D) (UV+EPS balls) 또한 유사한 추세를 나타냈으며, 이러한 결과는 광촉매에 의한 효과보다는 UV 조사에 의한 광분해(photolysis)를 통해 조류성장 저해가 발생하는 것으로 판단된다. 그러나 실내 실험의 셀 개체수 변화는 A (Control) 대비 광분해와 광촉매(photocatalysis)를 적용한 모든 시험군의 셀 개체수가 시간이 경과함에 따라 유사한 수치를 나타내었다(Fig. 2(a) 참조).
자연광 조사 하에서 실외 실험 중 TiEPS balls의 수면적 도포 비율에 따른 조류성장 억제효과를 비교(Fig. 2(b_B vs C))한 결과, TiEPS balls의 적용 비율이 증가함에 따라 조류성장 억제 효과가 비례해서 증대되는 경향을 보였다. 또한, Fig. 2(b_B) (TiEPS balls 50%)의 경우 M. aeruginosa의 성장이 지속적으로 억제되는 것으로 보아 조류의 분해율이 성장율보다 빠른 것으로 판단되며, 이를 통해 TiEPS balls의 표면적 적용 비율 50% 이상에서 M. aeruginosa의 증식이 억제 가능한 것으로 판단된다. Fig. 2(b_C) (TiEPS balls 100%)의 경우 70 시간 경과 이후부터 명확하게 M. aeruginosa의 성장저해가 관측되는 것으로 보아 조류의 분해율이 성장율보다 빠른 것으로 관측되었으나, Fig. 2(b_D) (EPS balls 100%) 또한 Fig. 2(b_C) (TiEPS balls 100%)와 유사한 추세를 나타내는 것으로 조사되어 TiEPS balls에 의한 조류성장 억제의 주요 기작이 초기에는 광분해인 반면, 장기적으로는 차광이 주요 기작인 것으로 판단된다(Fig. 2(b) 참조).
셀 형태(cell morphology) 분석결과, 실내・외 실험 중 TiEPS balls을 적용한 실험군 모두 세포 밖으로 세포액이 용출되고 세포막의 형태가 불균일하게 일그러지는 형태를 나타내었다(Fig. 3 참조). 반면에 M. aeruginosa의 명확한 성장저해가 관측되었던 실내 실험(a) 중 B (UV only)와 같이 UV가 수중 조류에 직접 조사된 경우, 세포막의 형태 변화가 아닌 셀 내부 색소자체의 탈색에 의해 광학현미경을 통한 관찰 시 계수가 불가하였으며, 이는 직접적인 UV 조사로 인해 살조된 것으로 판단된다. 유사한 연구에서도 UV를 통한 우수한 조류의 사멸 및 제거효과를 보고하였다[33,34].
비록 실내・외의 TiO2가 부착되지 않은 EPS balls을 적용한 실험군의 경우 TiEPS balls과 유사한 M. aeruginosa의 성장저해가 관측되었으나, 실험 기간 중 TiEPS balls을 적용한 실험군과 달리 EPS balls을 적용한 실험군은 세포막의 형태변화는 관측되지 않았다. 이를 통해 TiEPS balls의 세포막의 일부가 하이드록시 라디칼(OH・)과 슈퍼 옥사이드 음이온(O2-)의 공격으로 인해 일부 분해되어 내부기관이 용출된 것으로 판단된다. 또한 실내・외의 TiEPS balls이 적용된 시험군 모두 일정 시간 적용 후 지속적으로 셀 형태의 변화가 나타나는 것으로 보아 초기에 광분해 효과, 장기적으로는 광분해 효과 및 차광에 의한 시너지 효과가 주된 조류성장 저해 효과로 작용되는 것으로 판단된다.
3.2. Chlorophyll-a 농도변화Chlorophyll-a 농도변화도 셀 개체수 변화와 유사한 결과를 나타내었으며, 실내・외 대조군 A (Control)의 경우 지속적으로 성장 혹은 유지되어 M. aeruginosa의 성장속도 저해 현상은 관측되지 않아 대조군 실험조건에서 주요한 성장저해 요인은 없는 것으로 판단되었다. 실내의 TiEPS balls 적용 유무에 따른 Chl-a 분석 결과, TiEPS balls이 적용되지 않은 B (UV only)의 경우 TiEPS balls이 적용되어 UV가 차광된 C (UV+TiEPS balls)와 비교하여 UV가 수중에 직접 조사되어 조류의 사멸이 촉진된 것으로 판단되며, 시험군 중 가장 높은 Chl-a 저감률을 보였다. 반면에 TiEPS balls이 적용된 C (UV+TiEPS balls)의 경우 실험기간 중 Chl-a의 수치가 저감되어 조류의 성장 속도의 지연이 관측되나 B (UV only)보다 낮은 저감률을 나타내며, 실험기간 중 TiO2가 부착되지 않은 EPS balls이 적용된 D (EPS balls)와 유사한 추세를 나타내었다. 또한 UV의 살조효과를 차광시켜 B (UV only) 대비 조류성장 저해 속도를 지연시키는 것으로 판단되나, 결론적으로 대조군(A)대비 낮은 Chl-a의 수치를 나타내었다(Fig. 4(a) 참조).
실외의 TiEPS balls의 수면적 도포 비율에 따른 Chl-a 분석 결과, 셀 개체수의 결과와 유사하게 TiEPS balls의 수면적 도포 비율이 증가함에 따라 조류성장 억제 효과가 비례하게 증대되는 것으로 나타났다. 또한 TiO2 부착 유무에 따른 Chl-a 분석 결과, TiEPS balls이 적용된 Fig. 4(b_C) (TiEPS balls 100%)와 TiO2가 부착되지 않은 EPS balls이 적용된 Fig. 4(b_D) (EPS balls 100%)가 실험 기간 중 유사한 추세를 보이나, 셀 형태 및 셀 개체수의 결과와 Chl-a의 농도변화를 종합한 결과, TiEPS balls을 활용해 조류의 과도한 성장억제 효과는 적용 초기에는 광분해, 장기적으로 광분해와 차광에 의한 상승효과가 주된 조류성장 억제 효과로 작용되는 것으로 확인되었다(Fig. 4(b) 참조). 따라서, 정체수역에 적용되어 초기에 TiEPS balls의 광촉매기작을 통해 조류의 과도한 성장을 억제하며, 이후 TiEPS balls에서 광촉매가 탈리되어도 EPS balls의 차광을 통해서 장기적으로 조류성장을 억제할 수 있으리라 판단된다.
3.3. 성장률(growth rate)과 일차 분해율(first-order degradation) 분석실내 실험(a)의 대조군 A (Control)의 성장률(growth rate) 실험 결과, 지속적으로 비성장속도 상수(µ)가 유지되어 M. aeruginosa의 성장속도 저해 현상은 관측되지 않아 대조군 실험조건에서 실험기간 중 주요한 증식저해 요인은 없는 것으로 확인되었다. TiEPS balls의 적용 유무에 따른 일차분해속도상수(k) 실험 결과, B (UV only)의 경우 과도한 UV의 조사로 인해 M. aeruginosa의 사멸이 촉진되어 다른 실험군 대비 높은 일차 분해율(k=0.655 day-1)을 나타내었다. 또한 C (UV+TiEPS balls)의 경우 성장률 대비 높은 분해율(k=0.473 day-1)을 나타냈다. D (UV+EPS balls)의 경우도 셀 개체수 및 Chl-a 결과와 유사하게 차광효과가 주된 조류성장 억제 기작으로 작용함에 따라 C (UV+TiEPS balls)와 유사한 높은 분해율(k=0.471 day-1)을 나타냈다(Fig. 5(a), Table 2).
실외 실험(b)의 대조군 A (Control)의 성장률 실험 결과, 자연광 하에서 점진적으로 증가하는 성장률을 보이며, M. aeruginosa의 성장속도 저해 현상은 관측되지 않아 대조군 실험조건에서 실험기간 중 주요한 증식저해 요인은 없는 것으로 판단되었다. TiEPS balls의 적용 비율에 따른 일차 분해율 실험 결과, B (TiEPS balls 50%)(k=0.006 day-1) 대비 C (TiEPS balls 100%)(k=0.103 day-1)의 일차분해속도상수(k)가 약 18배 높은 수치를 나타내며, 이를 통해 수면적 도포비율의 증가에 따른 조류성장 억제효과가 크게 증대되는 것으로 조사되었다. 또한 B (TiEPS balls 50%)의 경우 실험군 중 가장 낮은 일차분해속도상수(k=0.006 day-1)를 나타냈으나, 세포막 형태의 변화를 근거로 OH radical (OH・)에 의한 광분해 효과를 통해 M. aeruginosa의 비성장속도(µ)가 감소되어 성장이 지연되는 것으로 판단된다. 또한, D (EPS balls 100%)(k=0.086 day-1) 대비 C (TiEPS balls 100%)(k=0.103 day-1)의 일차분해속도상수(k)가 높은 수치를 나타내며, 이러한 결과를 통해 초기의 광분해 작용 이후 시간이 경과함에 따라 차광에 의한 조류성장 억제 효과가 주요기작으로 작용되는 것으로 실내・외 실험에서 동일한 결론을 도출할 수 있었다(Fig. 5(b), Table 2).
3.4. Microcystin-LR, RR 농도변화TiEPS balls을 활용한 광촉매 분해를 통해 M. aeruginosa의 세포막 파괴로부터 용출되는 간 독성물질인 microcystin의 분해 여부를 확인하기 위해 microcystin-LR, RR 분석 결과를 Fig. 6에 제시하였다. Microcystin은 약 60개의 다양한 구조가 확인되었으며, microcystin-LR, -RR 및 -YR이 가장 일반적인 종류로 microcystin-LR이 가장 강한 독성을 가진 것으로 알려져 있다[35].
실내 실험의 대조군의 실험초기(initial)와 실험종료(95 h)의 microcystin은 대부분 microcystin-RR 형태로 존재하고 있으며, 95시간 경과 후 용존성 microcystin 대비 입자성 microcystin이 존재하는 것으로 보아 대조군의 셀 개체수의 사멸 현상이 발생하지 않은 것으로 판단된다. 반면에, 대조군(A) 제외 모든 실험군에서는 형태와 무관하게 microcystin이 모두 분해되어 검출한계 미만으로 제거되는 것으로 나타났다. 또한 대조군 대비 모든 실험군에서 입자성과 용존성 microcystin이 검출되지 않은 것으로 보아 입자성과 용존성 microcystin 모두 분해된 것으로 조사되었다. 이러한 결과를 통해, 실험기간 중 UV 또는 TiEPS balls에 의해 조류증식 억제효과와 동시에 M. aeruginosa로부터 용출되는 microcystin까지 검출한계 미만으로 분해되어, TiEPS balls을 활용한 광촉매 분해로 인해 M. aeruginosa의 증식저해 및 세포막 파괴로부터 용출되는 독성물질 또한 분해되는 것으로 확인되었다(Fig. 6 참조).
4. 결 론저비용이고 열적변형이 뛰어난 발포성 폴리스틸렌(expanded polystyrene, EPS) 소재의 수면 부유 지지체에 나노크기 TiO2 입자를 부착/내재시킬 수 있는 경제적이고 실용적인 TiO2-embedded expanded polystyrene balls (TiEPS balls) 고정화 공법을 개발해 TiEPS balls을 대량생산하였다. 개발된 TiEPS balls을 하천/호수의 수면에 현장적용 전에 Microcystis aeruginosa (M. aeruginosa)의 성장 억제(growth inhibition) 효과를 다양한 조건이 적용된 실내・외 실험을 통해 셀 형태(cell morphology), 셀 개체수(cell number)와 chlorophyll-a (Chl-a), 비성장속도(µ)와 일차분해속도상수(k), microcystin-LR, RR의 변화를 비교・분석하여 TiEPS balls이 조류발생을 사전예방하고 지속가능하게 조류증식을 예방할 수 있는지에 대해 검증하였다. 본 연구의 결과는 다음과 같다.
1) 셀 개체수(cell number)와 chlorophyll-a (Chl-a)의 분석 결과, 실내실험 결과 UV 조사 조건에서 TiEPS balls을 적용 시 지속적으로 조류성장을 억제하는 효과를 확인하였다. 실외실험 결과 TiEPS balls의 적용 비율이 증가함에 따라 조류성장 억제 효과가 비례하게 증대되며, D (EPS balls 100%) 대비 C (TiEPS balls 100%)의 분해율(k)이 높은 수치로 조사되어 조류의 증식억제는 적용 초기에는 광분해, 장기적으로 광분해와 차광에 의한 상승효과가 주된 조류성장 억제효과로 판단된다.
2) 셀 형태(cell morphology) 분석결과, 실내・외 실험 중 TiEPS balls을 적용한 시험군 모두 세포 밖으로 세포액이 용출되고 세포막의 형태가 불균일하게 파괴되는 형태를 나타내었다. 따라서 세포막의 일부가 하이드록시 라디칼(OH・)과 슈퍼 옥사이드 음이온(O2-)의 공격으로 인해 일부 분해되어 내부기관이 용출된 것으로 판단된다.
3) 비성장속도(µ)와 일차분해속도상수(k)의 분석결과, 실내실험의 경우 C (UV+TiEPS balls)의 결과를 통해 성장률 대비 높은 분해율을 나타냈으며, 실외실험의 경우 TiEPS balls의 수면적 도포비율 증가에 따라 조류성장 억제효과가 크게 증대되는 것으로 조사되었다.
4) Microcystin-LR, RR 분석 결과, 대조군 제외 모든 실험군에서 microcystin이 검출한계 미만으로 제거되며, 입자성과 용존성 microcystin 모두 분해된 것으로 조사되었다. 따라서, TiEPS balls을 활용한 광촉매 분해로 인해 M. aeruginosa의 증식저해 및 세포막 파괴로부터 용출되는 독성물질 또한 분해되는 것으로 확인되었다.
5) 본 연구에서 개발된 TiEPS balls을 적용하여 남조류인 Microcystis aeruginosa (M. aeruginosa)의 성장저해효과(growth inhibition effect)를 검증하기 위한 다양한 실험실 규모 실내・외 실험을 실시한 결과, TiEPS balls는 초기의 광분해와 시간이 경과 후 차광의 시너지 효과를 통해 조류성장 억제효과를 나타내며, 현장적용 시 남조류가 과다 번성하는 우심 구간에 TiEPS balls을 상시 부유시켜 남조류의 과다성장을 예방할 수 있을 것으로 판단된다.
Fig. 1.Pictorial view of lab-scale indoor and outdoor experiments; (a) indoor experiment, and (b) outdoor experiment. 
Fig. 2.Changes in cell number of Microcystis aeruginosa in lab-scale growth inhibition experiment using TiO2-embedded expanded polystyrene (TiEPS) balls with different conditions; (a) indoor experiment, and (b) outdoor experiment. 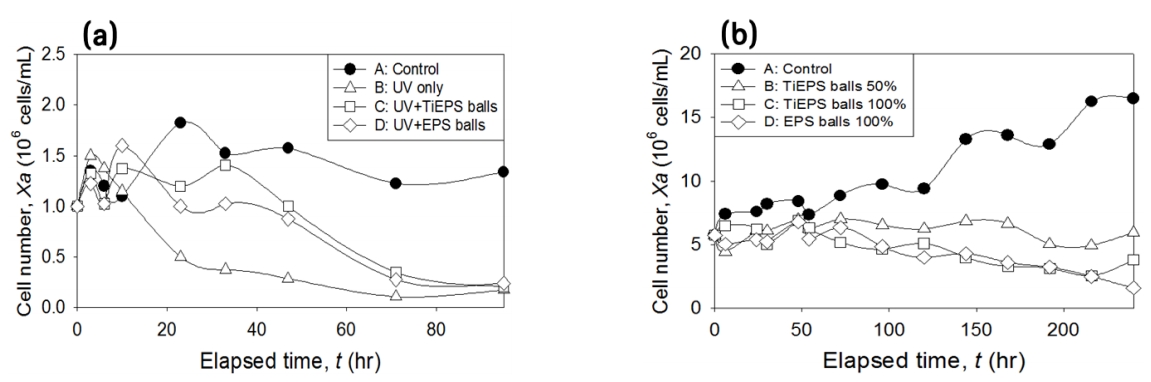
Fig. 3.Comparison of cell shape and morphology in the lab-scale growth inhibition experiment against the growth of Microcystis aeruginosa; (a) UV+EPS balls in indoor experiment, (b) UV+TiEPS balls in indoor experiment, (c) TiEPS balls (50%) in outdoor experiment, and (d) TiEPS balls (100%) in outdoor experiment. (Note: circles indicate the distorted and ruptured cells) 
Fig. 4.Changes in chlorophyll-a of Microcystis aeruginosa in lab-scale growth inhibition experiment using TiO2-embedded expanded polystyrene (TiEPS) balls with different conditions; (a) indoor experiment, and (b) outdoor experiment. 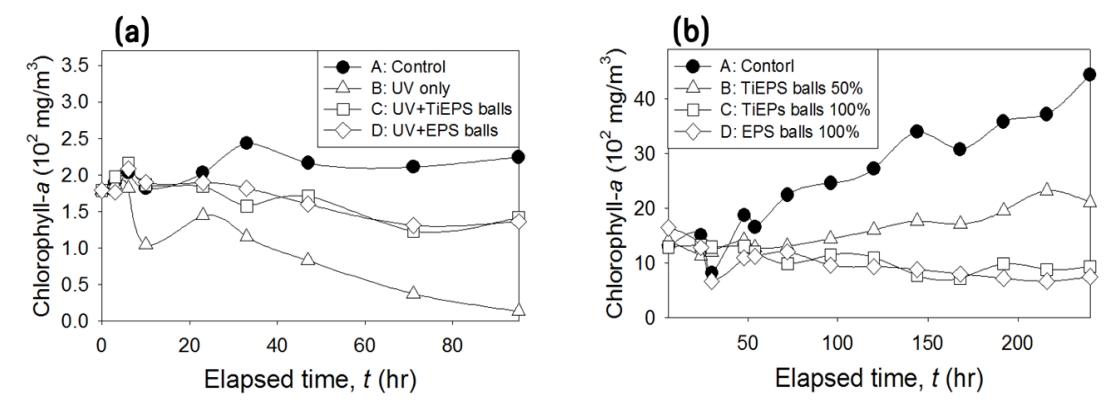
Fig. 5.Changes in specific growth rate (µ) and first order decay constant (k) of Microcystis aeruginosa in lab-scale growth inhibition experiment using TiO2-embedded expanded polystyrene (TiEPS) balls with different conditions; (a) indoor experiment, and (b) outdoor experiment. 
Fig. 6.Changes in microcystin-LR, RR of Microcystis aeruginosa in lab-scale growth inhibition experiment at indoor using TiO2-embedded expanded polystyrene (TiEPS) balls; (a) dissolved toxin, and (b) particulate toxin. 
Table 1.Composition of CB media used for cultivation of Microcystis aeruginosa. Table 2.Summary of specific growth rate (µ) and first order decay constant (k) of Microcystis aeruginosa in lab-scale growth inhibition experiment using TiO2-embedded expanded polystyrene (TiEPS) balls with different conditions. References1. J. A. Raven, M. Giordano, C. B.. Algae, 24(13), R590-R595(2014).
3. ME, Algal bloom, What is the algal bloom? (2016).
4. H. K. Park, Causes of green algae and countermeasures for reduction, Bull. Korea Environ. Preserv. Assoc., 412, 17-21(2014).
5. G. S. Nam, E. H. Lee, M. Kim, Y. S. Pae, H. Y. Eum, Characteristics of aquatic environment and algal bloom in a small-scaled agricultural reservoir (jundae reservoir), Korean J. Environ. Biol., 31(4), 429-439(2013).
6. S. Y. Chung, J. I. Ko, B. G. Kwon, U. Salma, Isolation of bacterial strains inhibiting the growth of Microcystis aeruginosa and cyanobacterium growth inhibition assay, J. Wet. Res., 19(4), 443-450(2017).
7. J. C. Joo, C. H. Ahn, S. Lee, D. G. Jang, W. H. Lee, B. R. Ryu, Algal growth potential of Microcystis aeruginosa from reclaimed water, Water Environ. Res., 88(1), 54-62(2016).
8. W. O. Grabow, W. C. Du Randt, O. W. Prozesky, W. E. Scott, Microcystis aeruginosa toxin: cell culture toxicity, hemolysis, and muagenicity assays, Appl. Environ. Microbiol., 43(6), 1425-1433(1982).
9. E. D. Hilborn, V. A. Roberts, L. Backer, E. Deconno, J. S. Egan, J. B. Hyde, D. C. Nicholas, E. J. Wiegert, L. M. Billing, M. Diorio, M. C. Mohr, J. G. Hardy, T. J. Wade, J. S. Yoder, M. C. Hlavsa, Algal bloom-associated disease outbreaks among users of freshwater lakes-united states, MMWR., 63(1), 11-15(2014).
10. L. Mhlanga, J. Chimbari, M. Day, N. Siziba, Observtions on limnological conditions associated with a fish kill of oreochromis niloticus in lake chivero following collapse of an algal bloom, Afr. J. Ecol., 44(2), 199-208(2006).
11. ME, Manual for operation of algae alert system(2015).
12. ME, Research on improvement of algae management system through operation of algae expert forum(2013).
13. KECO, Algae removal technologies for the healthiness of aquaculture(2012).
14. ME, Algal removal master plan from domestic fresh water(2012).
15. H. K. Oh, H. C. Lee, J. Y. Cha, Estimating the value of water quality improvement using the contingent valuation method: A case study on bloom forming algae, J. Environ. Policy and Admin., 23, 115-135(2015).
16. K. D. Byeon, G. Y. Kim, I. J. Lee, S. Lee, J. R. Park, T. M. Hwang, J. C. Joo, Investigation and evaluation of algae removal technologies applied in domestic rivers and lakes, J. Korean Soc. Environ. Eng., 38(7), 387-394(2016).
17. K. Maeda, K. Teramura, D. Lu, T. Takata, N. Saito, Y. Inoue, K. Domen, Photocatalyst releasing hydrogen from water, Nature., 440(7082), 295(2006).
18. Q. Xiang, J. Yu, P. K. Wong, Quantitative characterization of hydroxyl radicals produced by various photocatalysts, J. Colloid Interface Sci., 357(1), 163-167(2011).
19. D. Chatterjee, S. Dasgupta, Visible light induced photocatalytic degradation of organic pollutants, J. Photochem. Photobiol., C., 6(2-3), 186-205(2005).
20. M. N. Chong, B. Jin, C. W. K. Chow, C. Saint, Saint, Recent developments in photocatalytic water treatment technology: A review, Water Res., 44(10), 2997-3027(2010).
22. P. Puchera, M. Benmamib, R. Azouanib, G. Krammera, K. Chhorb, J. F. Bocquetb, A. V. Kanaevb, Nano-TiO2 sols immobilized on porous silica as new efficient photocatalyst, Appl. Catal., A., 332(2), 297-303(2007).
23. J. F. Guo, B. Ma, A. Yin, K. Fan, W. L. Dai, Highly stable and efficient Ag/AgCl@TiO2 photocatalyst: Preparation, characterization, and application in the treatment of aqueous hazardous pollutants, J. Hazard. Mater., 211-212, 77-82(2012).
24. H. J. Yu, Progress of TiO2 photocatalytic oxidation technology in algae removal, Adv. Mat. Res., 631-632, 246-253(2013).
25. T. Fotiou, T. Triantis, T. Kaloudis, A. Hiskia, solar and visible light using TiO2. mineralization and intermediate products, Chemosphere., 119, S89-S94(2015).
26. J. C. Joo, G. Y. Kim, C. H. Ahn, S. Lee, J. R. Park, J. K. Kim, J. M. Oh, Application of titanium dioxide (TiO2)-embedded buoyant photocatalyst balls using expanded polystyrene, J. Nanosci. Nanotechnol., 19(2), 1151-1154(2019).
27. L. W. Lee, S. Obregon-Alfaro, V. Rodriguez-Gonzalez, Photocatalytic coatings of silver-TiO2 nanocomposites on foamed waste-glass prepared by sonochemical process, A., 221(1), 71-76(2011).
28. J. J. Song, S. H. Cho, S. W. Lee, T. H. Kim, Y. Hayashi, Removing algae with pt-doped TiO2 coatings on foamed glass, Mater. Sci. Forum., 544-545, 135-138(2007).
29. G. Y. Kim, J. C. Joo, B. R. Ahn, D. H. Lee, J. R. Park, C. H. Ahn, J. M. Oh, Inhibition of the algal growth using TiO2-embedded expanded polystyrene (EPS) balls in lab-scale outdoor experiment, Ecol. Resil. Infrastruct., 5(3), 174-179(2018).
30. J. C. Joo, G. Y. Kim, C. H. Ahn, S. Lee, J. R. Park, J. K. Kim, Development of titanium dioxide (TiO2)-embedded buoyant photocatalyst balls using expanded polystyrene, J. Nanosci. Nanotechnol., 19(2), 1065-1068(2019).
31. NIER, A study on the production and behavior of cyanobacterial toxin(2007).
32. C. J. Lorenzen, Determination of chlorophyll and pheo-pigments: spectrophotometric equations, Limnol. Oceanogr., 12(2), 343-346(1967).
33. M. Z. B. Alam, M. Otaki, H. Furumai, S. Ohgaki, Direct and indirect inactivation of Microcystis aeruginosa by UV-radiation, Water Res., 35(4), 1008-1014(2001).
34. H. Ou, N. Gao, Y. Deng, J. Qiao, H. Wang, Immediate and long-term impacts of uv-c irradiation on photosynthetic capacity, Water Res., 46(4), 1241-1250(2012).
35. K. Sivonen, J. Jones, Cyanobacterial toxins. pp. 41-111Toxic cyanobacteria in water. a guide to their public health consequences, monitoring and managementI. Chorus, J. Bartram(Eds.), E and FN Spon (on be half of WHO), London(1999).
|
|
||||||||||||||||||||||||||||||||||||