The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
BAC 공정에서 에스트로겐류 생물분해능 및 생물분해 동력학 평가
Abstract
In this study, The effects of empty bed contact time (EBCT) and water temperature on the biodegradation of 4 estrogens in biological activated carbon (BAC) process were investigated. Experiments were conducted at three water temperatures (5℃, 15℃ and 25℃) and three EBCTs (5, 10 and 15 min). Increasing EBCT and water temperature increased the biodegradation efficiency of estrogens in BAC column. E2 was the highest biodegradation efficiency, but E3 was the lowest. The kinetic analysis suggested a pseudo first-order reaction model for biodegradation of 4 estrogens at various water temperatures and EBCTs in the BAC columns. The first-order biodegradation rate constants (kbio) of 4 estrogens ranging from 0.1729~0.2511 min-1 at 5℃ to 0.3833~0.6094 min-1 at 25℃ in the BAC columns. By increasing the water temperature from 5℃ to 25℃, the biodegradation rate constants (kbio) were increased 2.2~2.4 times in the BAC columns.
Key words: Estrogens, Biological Activated Carbon (BAC) Process, Biodegradation, Water Temperature, Empty Bed Contact Time (EBCT)
요약
본 연구에서는 BAC 공정에서 EBCT 및 수온변화에 따른 에스트로겐류 4종에 대한 생물분해 제거특성을 조사하였다. 생물활성탄 공정에서 에스트로겐류 4종의 생물분해율은 EBCT와 수온에 따라 큰 영향을 받았으며 EBCT와 수온이 증가할수 록 생물분해율이 증가하였다. 에스트로겐류의 4종의 생물분해능은 E2가 가장 높았으며, 다음으로 E1, EE2 및 E3로 평가되었 다. 또한, 에스트로겐류의 4종에 대한 BAC 공정에서의 생물분해 속도상수(kbio)는 수온 5℃에서 25℃로 상승하였을 경우, 0.1729~0.2511 min-1에서 0.3833~0.6094 min-1로 2.2배~2.4배 정도 증가하였다.
주제어: 스트로겐류, 생물활성탄 공정, 생물분해, 수온, 공탑체류시간
1. 서 론
분석기술의 발달로 인해 다양한 미량 신종 오염물질들이 상수원에서 빈번히 검출되고 있다. 특히, 이러한 물질들 중 에스트로겐류(estrogens)는 인간과 동물들에게 있어 내분비계 교란을 유발하기 때문에 최근에 많은 관심의 대상이 되고 있다[ 1~ 3]. 에스트로겐류는 estrone (E1), 17β-estradiol (E2), esrtriol (E3)와 같은 천연 에스트로겐과 호르몬 치료제와 피임약 등에 사용되는 17α-ethinylestradiol (EE2)와 같은 합성 에스트로겐으로 분류된다. 에스트로겐류가 수환경에 유입될 경우 매우 낮은 농도 수준(ng/L)에서도 어류의 성장률 저하, 생식력 감소 및 암컷화(feminisation)를 유발하며[ 4~ 6], 인체 내에서는 정자 수의 감소 및 고환암, 난소암, 유방암을 유발하는 것으로 알려져 있다[ 7, 8]. 따라서 미국 환경보호국(EPA)에서는 에스트로겐류를 먹는물 오염물질 후보 등재목록(Contaminant Candidate List, CCL)에 포함시켜 관리하고 있다[ 9]. 이들 에스트로겐류는 동물의 분변을 거름으로 사용하는 농지에서 강이나 호소 등으로 직접 유입[ 10, 11]되거나 가정 하수와 낙농 폐수에서 유래되며[ 12~ 14], 하·폐수처리장에서 완전히 제거되지 않은 에스트로겐류들이 지표수, 지하수 및 심지어 수돗물에서도 검출되는 것으로 보고되었다[ 13, 15]. 하·폐수 및 정수처리 공정에서 에스트로겐류의 제거를 위해 멤브레인 공정[ 16~ 18], 산화 공정[ 14, 19], 입상활성탄(granular activated carbon, GAC) 흡착공정[ 3, 20, 21]과 같은 물리·화학적 처리공정들 및 생물활성탄(biological activated carbon, BAC) 공정, 활성슬러지 공정 등과 같은 생물학적 처리공정[ 22, 23]들을 이용한 연구결과들이 많이 보고되어 있다. 특히, 에스트로겐류는 생물학적 처리공정에서 비교적 용이하게 생물분해되는 것으로 보고되었다[ 24, 25]. 정수처리에서 활성탄 공정은 수중에 함유된 미량 오염물질들을 효과적으로 제거할 수 있는 공정으로 운전 초기에는 흡착이 주요 제거기작인 반면에 운전 기간이 증가할수록 박테리아들의 자연적인 부착에 의해 형성된 생물막(biofilm)에 의한 생물분해가 주요 제거기작이 된다[ 26]. 정수처리 공정의 활성탄 공정에서 E1과 E2의 제거에 대해 연구한 Li 등의 연구결과[ 23]에서는 E1과 E2의 경우 GAC 공정에서의 흡착 보다는 BAC 공정에서의 생물분해에 의해 효과적으로 제거되는 것으로 보고하고 있다. 그러나 생물학적 처리효율에 가장 큰 영향을 미치는 수온변화에 따른 에스트로겐류 제거능 변화에 대한 평가는 이루어지지 않았다. 호기성 조건에서 E2의 회분식 생물분해 실험을 수행한 Li 등의 연구결과[ 27]에서 수온 변화는 제거율에 매우 큰 영향을 미치는 것으로 보고하고 있어 수온 저하에 따른 에스트로겐류의 제거능 평가는 반드시 필요한 연구이다. 본 연구에서는 국내의 대규모 정수장들에서 채택하여 운전 중인 BAC 공정에서의 estrone (E1)과 17β-estradiol (E2) 뿐만 아니라 상수원수에서 비교적 검출빈도가 높은 esrtriol (E3)와 17α-ethinyl estradiol (EE2)에 대한 제거능을 수온 및 공탑 체류시간(empty bed contact time, EBCT)의 변화와 연계하여 평가하고자 하였다. 또한 생물분해 동력학 평가를 수행하여 향후 정수장의 BAC 공정으로 에스트로겐류가 유입될 경우에 에스트로겐류의 완전 제거에 필요한 EBCT의 예측이 가능하도록 하는 것이 목적이다.
2. 실험재료 및 방법
2.1. 에스트로겐류 및 유입수 성상
실험에 사용된 합성 에스트로겐류는 estrone (E1), 17β-estradiol (E2), estriol (E3) 및 17α-ethinyl estradiol (EE2) 4종이며, E1~E3는 Dr. Ehrenstorfer사 및 EE2와 내부표준물질로 사용된 E2-13C 3은 Sigma-aldrich사에서 구매하여 실험에 사용하였다. 4종의 호르몬류에 대한 물리화학적인 특성을 Table 1에 나타내었다. 실제 정수장의 BAC 공정과 동일한 운전조건으로 실험을 수행하기 위하여 유입수로는 pilotplant(처리용량 : 300톤/일)의 후오존 처리수를 사용하였다. 4종의 에스트로겐류를 후오존 처리수에 투입하여 lab-scale biofilter와 BAC 컬럼으로 유입되는 에스트로겐류 4종 각각의 농도가 50 ng/L가 되도록 하였다. Table 2에는 실험에 사용된 유입수(후오존 처리수)의 성상을 나타내었다.
2.2. Lab-scale BAC와 biofilter 컬럼 운전조건
본 실험에 사용된 BAC 및 biofilter는 석탄계 활성탄(F400, Calgon, USA) 및 안트라사이트(한국 안트라사이트)로 입경은 8~30 mesh이며, 낙동강 원수를 정수처리하는 pilot-plant에서 3년 6개월 정도 사용(운전 bed volume : 187,000 정도)한 것을 채집하여 실험에 사용하였다. 채집한 BAC와 안트라사이트를 각각의 컬럼들에 실험조건에 맞추어 충진하고 수온을 20℃로 조절하여 2주간 순응시킨 후 각각의 컬럼 표층 부분의 생물활성탄과 안트라사이트를 채집하여 부착 박테리아 생체량과 활성도를 측정한 결과를 Table 3에 나타내었다. 활성탄(BAC)의 경우가 안트라사이트(biofilter)에 비해 생체량은 22배, 활성도는 1.6배 정도 높게 나타났다. Lab-scale BAC 및 biofilter 컬럼의 운전은 후오존 처리수에 에스트로겐류 4종을 각각 50 ng/L의 농도로 80 L 용량의 유입수 조에 투입 후 정량펌프(MASTER Flex Ⓡ L/S, Cole-Parmer, USA)를 사용하여 유입수 조에서 18 mL/min으로 분배조(distributor)로 이송한 후 6개의 투명 아크릴 컬럼(직경 2 cm, 길이 20 cm)으로 3 mL/min 씩 균등하게 분배되도록 하였다. 컬럼 내 활성탄을 각각 15, 30, 45 mL 씩 충진하여 EBCT가 5, 10, 15분이 되도록 조절하였고, 6개의 컬럼들은 하향류 방식으로 운전하였으며, 시스템의 개략도를 Fig. 1에 나타내었다. 역세척은 각각의 컬럼 하부로 처리수를 공급하여 활성탄 층이 50% 정도 팽창되는 조건에서 주 1회 실시하였고, 공세는 실시하지 않았다. 컬럼 내부의 수온변화는 Fig. 1에서와 같이 수온조절 장치(Buchi, Recirculating chiller B-740, Swiss)를 이용하여 수온을 5℃, 15℃ 및 25℃로 조절하였으며, 수온 조절 후 4주간 변화된 수온에 대한 순응기간을 거친 후 실험을 실시하였다.
2.3. 회분식 생물분해 실험
에스트로겐류 4종에 대한 회분식 생물분해 실험은 Son 등의 방법[ 29]을 이용하였다. 300 mL BOD병에 무기 영양염을 보충[ 30]한 순수 200 mL를 채운 후, 에스트로겐류 4종을 1종씩 각각 50 ng/L의 농도로 각각의 BOD병에 투입하였다. 종속영양성 박테리아의 식종을 위해 3년 6개월간 운전한 BAC 컬럼의 상층부에서 생물활성탄을 채집하였다. 채집된 생물활성탄 1 g(습중량)을 생리식염수 20 mL가 담긴 멸균된 비이커에 투입한 후 초음파 처리하여 생물활성탄에 부착된 박테리아들을 탈리시켰다. 200 mL의 시료수(BOD병)들에 탈리된 부착 박테리아 식종액을 2 mL 씩 투입한 후 4종의 에스트로겐류가 각각 함유된 4개의 BOD병을 shaking incubator(HB201SF, 한백과학)에서 20℃, 150 rpm의 조건으로 배양하면서 회분식 생물분해 실험을 수행하였다.
2.4. 에스트로겐류 분석
4종의 에스트로겐류 분석을 위해 online-SPE 시스템이 장착된 LC-MS/MS (LC: Agilent, 1260, MS/MS: Agilent, 6490, USA)를 사용하였다. 시료수 900 μL를 online-SPE로 주입· 농축한 후 LC 이동상을 이용하여 SPE 카트리지에 농축된 에스트로겐류를 탈착시켜 LC 컬럼으로 주입하였다. 에스트로겐류 4종의 분리를 위해 Eclipse-C18 column (Agilent, 2.1 mm × 100 mm, 3.5 μm)을 사용하였으며, LC-MS/MS의 분석조건을 Table 4에 나타내었다. 또한, MS/MS 분석에 사용된 각각의 에스트로겐류의 precursor ion 및 product ion의 분자량과 fragment voltage 및 collision energy 값을 Table 5에 나타내었다. 에스트로겐류의 정량한계(LOQ)는 4종 모두 1 ng/L였다.
3. 결과 및 고찰
3.1. 에스트로겐류 4종의 회분식 생물분해 특성
생물활성탄에 부착되어 있는 박테리아를 각각의 회분식 생물반응기에 식종한 후 배양시간 경과에 따른 E1, E2, E3 및 EE2의 잔존율(C/C 0) 변화를 Fig. 2에 나타내었다. Fig. 2에서 볼 수 있듯이 E2는 배양 초기부터 비교적 빠른 생분해율을 나타내면서 배양시간 624시간 후에는 67% 정도 제거되었다. 또한, E1, EE2 및 E3의 경우는 E2에 비해 비교적 느린 생물분해능을 보였으며, 배양시간 624시간 후 각각 평균 55%, 47% 및 36% 정도 제거되어 BAC 부착 박테리아를 이용한 회분식 생물분해 실험결과 에스트로겐류의 생물분해능은 E2 > E1 > EE2 > E3로 평가되었다. 활성슬러지를 이용하여 에스트로겐류 4종의 회분식 생물분해에 대해 연구한 Shi 등의 연구결과[ 25]에서는 E2, E1, EE2 및 E3의 생물분해 속도상수( k)가 각각 1.3 h -1, 0.056 h -1, 0.035 h -1 및 0.030 h -1으로 다른 3종에 비해 월등히 높은 E2의 생물분해능을 보고하고 있다. 반면, Hashimoto와 Murakami의 연구결과[ 31]에서는 다양한 하수처리장의 활성슬러지를 이용하여 회분식 생물분해 실험을 수행한 결과, E1과 E2는 SRT 4시간의 조건에서 90% 이상의 유사한 생물분해율을 나타내었으며, EE2의 제거를 위해서는 E1과 E2에 비해 보다 긴 SRT (24시간)가 필요한 것으로 보고하고 있다.
3.2. Lab-scale BAC와 biofilter 공정에서의 에스트로겐류 생물분해 특성
3.2.1. 에스트로겐류 4종의 혼합투입에 따른 생물분해 특성
앞의 Fig. 2에 나타낸 회분식 생물분해 실험과는 달리 에스트로겐류 4종(각각의 유입농도는 50 ng/L)을 혼합하여 투입하였을 때, 유입수 및 BAC와 biofilter에서 EBCT 5분과 15분으로 처리한 처리수를 LC-MS/MS로 분석한 total ion chromatogram (TIC)을 Fig. 3에 나타내었다. 유입수( Fig. 3(a))와 biofilter 처리수( Fig. 3(b, c))의 TIC를 비교해보면 estrone (E1) peak (8.14 min)은 biofilter 처리 후에도 나머지 3종의 peak 크기에 비해 여전히 크게 나타난 것을 볼 수 있다. 그러나 BAC 처리수( Fig. 3(d, e))에서는 biofilter ( Fig. 3(b, c))에서와는 달리 estrone peak의 크기가 현저히 감소된 것으로 나타나 나머지 3종의 에스트로겐류와 마찬가지로 estrone이 BAC 컬럼에서는 원활히 제거되었다. 4종의 에스트로겐류 중에서 estrone (E1)의 제거율이 가장 저조하게 나타난 이유로는 박테리아에 의해 17β-estradiol (E2)이 estrone (E1)으로 전환[ 32]되기 때문으로, 유입수에 함유된 E2가 biofilter와 BAC 컬럼 내부에서 E1으로 전환되어 컬럼 내부에는 실제 투입농도 보다 더 높은 E1이 유입된 것과 유사한 결과를 나타내었기 때문이다. 또한, Biofilter 공정에 비해 BAC 공정에서 E1의 제거율이 높은 이유는 생물활성탄이 가지는 두 가지 메카니즘인 흡착과 생물분해 때문이다. 생물활성탄 표면은 생물막이 형성된 부분과 생물막이 형성되어 있지 않은 활성탄 표면 부분이 공존[ 33]하기 때문에 E2가 생물분해되어 E1으로 전환되기 전 활성탄에 일부 흡착 제거되고, 생물분해에 의해 E2에서 전환된 E1의 경우도 BAC에서 생물분해 뿐만 아니라 흡착에 의해서도 제거되기 때문이다. 활성탄(GAC)에 대한 흡착능의 경우 E1이 E2에 비해 2~4배 정도 높은 것으로 평가된다[ 23]. 따라서 E1의 제거시 생물활성탄 공정이 biofilter 공정에 비해 매우 우수한 제거능을 나타낸다. Biofilter 공정의 유입수에 E1과 E2가 동시에 잔존할 경우, E1의 완전한 제거를 위해서는 E2에서 E1으로 전환과 E1의 생분해까지 고려하여 E2의 제거에 필요한 EBCT에 비해 2배 이상의 EBCT가 필요한 것으로 나타났다. Weber 등[ 24]과 Yu 등[ 32]은 E1과 E2가 수중에 함께 잔존할 때 E2가 생물분해되는 동안에는 E1의 생물분해는 지체되는 현상(time limiting step)을 나타내었으며, 충분한 접촉시간이 주어지면 E1에 대한 높은 제거율을 얻을 수 있다고 보고하였다. 이전의 연구결과들을 종합하여 하수처리장의 활성슬러지에서 분리한 다양한 박테리아들에 의한 E2, E1 및 EE2의 생물분해 경로를 Fig. 4에 요약하여 나타내었다. 수환경 중에서 검출되는 에스트로겐류의 대부분이 E2와 E1 [ 2, 3]이기 때문에 이전의 연구결과들이 대부분 이들에 관한 것이다. E2를 E1으로 분해하는 박테리아 그룹은 Achromobacter sp. [ 24], Acinetobacter sp. [ 33], Nitrosomonas sp. [ 34], Pseudomonas sp. [ 33], Ralstonia sp. [ 24, 33], Rhodococcus sp. [ 35], Sphingobacterium sp. [ 36], Sphingomonas sp. [ 37] 및 Stenotrophomonas sp. [ 38] 등이 있으며, 몇몇 그룹들은 E1의 분해에도 관여한다. 특히, Nitrosomonas europaea [ 34], Rhodococcus zopfii와 Rhodococcus equi [ 35] 및 Sphingobacterium sp. JCR5 [ 36]는 EE2를 효과적으로 분해하는 것으로 보고하고 있다. Kurisu 등[ 37]은 토양에서 분리한 Rhodococcus sp.와 Sphingomonas sp., Lee와 Liu [ 39]는 활성슬러지에 서식하는 혼합 박테리아, Li 등[ 38]은 활성슬러지에서 분리한 Stenotrophomonas maltophilia 및 Haiyan 등[ 36]은 활성슬러지에서 분리한 Sphingobacterium sp. JCR5를 이용한 E2, E1 및 EE2의 생물분해 경로를 Fig. 4에서와 같이 제안하였다. Haiyan 등[ 36]의 연구결과에서는 EE2의 경우 단시간 내에 E1으로 생분해된 후, B고리와 A고리의 열림(cleavage)이 발생하면서 점진적인 생물분해가 진행된다고 보고하고 있다. 낙동강 하류에 위치한 정수처리 공정의 생물활성탄 부착 박테리아의 군집분석을 평가한 Son 등의 연구결과[ 40, 41]들에서 E1, E2 및 EE2를 분해할 수 있는 Pseudomonas sp., Sphingomonas sp. 및 Rhodococcus equi 등이 주요 우점종으로 보고하고 있다.
3.2.2. EBCT 변화에 따른 에스트로겐류 생물분해 특성
유입수의 수온이 15℃일 때 에스트로겐류 4종 각각을 50 ng/L의 농도로 개별 투입하여 BAC 및 biofilter에서의 EBCT 5분~15분에 대한 제거율 평가결과를 Fig. 5에 나타내었다. BAC 공정에서의 EBCT 변화에 따른 에스트로겐류 4종의 제거율 변화를 살펴보면 E3의 경우가 74.4% (EBCT 5분)~ 98.3% (EBCT 15분)의 제거율을 나타내어 에스트로겐류 4종중 가장 낮은 제거율을 보였으며, E2가 EBCT가 5분에서 15분으로 증가할수록 제거율은 90.5%에서 99.8%로 증가하여 에스트로겐류 4종중 가장 높은 제거율을 나타내었다.
Biofiltration 공정에서의 EBCT 변화에 따른 에스트로겐류 4종의 제거율 특성의 경우, 가장 낮은 제거율을 나타낸 물질은 BAC 공정에서와 마찬가지로 E3였으며, EBCT가 5분에서 15분으로 증가할수록 제거율은 15.0%~50.5%로 나타났다. 또한, 가장 높은 제거율을 나타낸 물질의 경우도 E2로 EBCT 5분~15분에서의 제거율이 각각 54.5%~79.0%로 나타났다.
BAC의 여재인 활성탄은 그 자체의 많은 세공(pore)으로 인해 종속영양성 박테리아들의 부착·서식이 유리한 반면, biofilter의 여재인 안트라사이트는 세공(pore)이 거의 없어 박테리아들의 군집 형성에는 활성탄 보다 불리하다. 이와 같이 박테리아의 서식 공간뿐만 아니라 종속영양성 박테리아의 유기탄소원 공급측면에서도 활성탄과 안트라사이트는 많은 차이가 보인다. 즉, 활성탄은 운전 초기부터 활성탄 표면에 유기성 오염물질들을 흡착하여 박테리아 군집으로 지속적인 유기탄소원의 공급이 유도되는 반면 안트라사이트는 흡착능이 없기 때문에 유기탄소원의 공급측면에서도 활성탄에 비해 수류의 흐름에 따라 생물막으로 전달되는 유기 탄소원을 제거하는 매우 수동적인 제거 메카니즘을 가진다[ 42]. 따라서 여재의 이러한 특성들로 인하여 BAC와 biofiter에서의 에스트로겐류 4종의 제거율에 많은 차이를 나타내었다.
3.3. 수온 변화에 따른 에스트로겐류 생분해 특성
BAC와 biofilter에서 유입수의 수온변화에 따른 에스트로겐류 4종에 대한 생물분해 특성 평가하였으며, E3와 E2의 결과를 Fig. 6에 나타내었다. BAC와 biofilter에서의 수온변화에 따른 E3의 제거 특성을 나타낸 Fig. 5(a)를 보면 수온이 5℃, 15℃ 및 25℃일 때 BAC 컬럼에서 EBCT 5분~15분에서의 제거율은 각각 60.0%~89.7%, 74.4%~98.3% 및 85.3%~99.7%로 나타났다. 또한, 수온이 5℃, 15℃ 및 25℃일 때 biofilter 컬럼에서 EBCT 5분~15분에서의 제거율은 각각 4.3%~32.3%, 15.0%~50.5% 및 24.7%~60.0%로 나타났다. 반면, 회분식 생물분해 실험에서 에스트로겐류 4종 중 가장 생물분해능이 높았던 E2에 대해 BAC와 biofilter에서의 수온변화에 따른 생분해 특성을 나타낸 Fig. 5(b)를 보면 수온이 5℃, 15℃ 및 25℃일 때 BAC 컬럼에서 EBCT 5분~15분에서의 제거율은 각각 73.1%~96.3%, 90.5%~99.8% 및 95.3%~100%로 나타났다. 또한, 수온이 5℃, 15℃ 및 25℃일 때 biofilter 컬럼에서 EBCT 5분~15분에서의 제거율은 각각 36.2%~63.4%, 54.5%~79.0% 및 66.9%~86.4%로 나타났다. 유입수의 수온변화에 따라 BAC와 biofilter 공정에서의 에스트로겐류에 대한 제거효율에는 많은 차이가 유발되었으며, 활성슬러지를 이용하여 수온변화에 따른 E1과 E2의 생물분해능을 평가한 Li 등의 연구결과[ 27]에서도 수온의 변화가 이들의 제거율에 가장 큰 영향을 미치는 인자로 평가하고 있다. BAC 공정에서는 수온 저하시에도 EBCT 15분 이상의 운전조건에서는 유입되는 에스트로겐 농도의 90% 이상 제거가 가능하였으나 biofilter 공정에서는 60% 이상의 제거율을 기대할 수 있었다. BAC 공정에서는 흡착과 생물분해 기작이 공존하여 수온 저하와 같은 부착 박테리아의 생물분해능 저하 요인이 유발되면 흡착과 생물분해 기작이 상호 경쟁 또는 보완적으로 작용하여 BAC 공정의 오염물질 제거능을 안정적으로 유지한다[ 33].
3.4. 에스트로겐류 4종의 생물분해 동력학 평가
BAC 및 biofilter 공정에서 각각의 EBCT에서 유입수 수온변화에 따른 에스트로겐류 4종의 생물분해율을 이용하여 pseudo-first order rate로 생물분해 속도상수(biodegradation rate constant, kbio)와 에스트로겐류 4종의 50% 제거시점인 반감기(half-life, t 1/2)를 구하였다(식 (1)과 식 (2)). 식 (1)과 식 (2)에서 C는 반응시간 후 농도, C 0는 초기 농도, kbio는 생물분해 속도상수, t는 반응시간(EBCT)이다. BAC와 biofilte 공정에서 유입수 수온이 5℃, 15℃ 및 25℃일 때의 4종의 에스트로겐류에 대한 평균 생물분해 속도상수( kbio)와 반감기(t 1/2)를 Table 6에 나타내었다. 수온 5℃~25℃일 때, 가장 낮은 생물분해율을 나타낸 E3의 경우 BAC 컬럼에서 kbio와 t 1/2이 각각 0.1729 min -1~0.3833 min -1 및 1.81 min~4.01 min이었으며, biofilter 컬럼에서는 kbio와 t 1/2이 각각0.0245 min -1~0.0583 min -1 및 11.89 min~28.29 min이었다. 또한, 수온 5℃~25℃일 때, 가장 높은 생물분해율을 나타낸 E2의 경우 BAC 컬럼에서 kbio와 t 1/2이 각각 0.2511 min -1~0.6094 min -1 및 1.14 min~2.76 min이었으며, biofilter 컬럼에서는 kbio와 t 1/2이 각각0.0695 min -1~0.1723 min -1 및 4.02 min~9.97 min이었다. 따라서 수온 5℃에서 25℃로 상승시 BAC 및 biofilter에서의 제거속도는 각각 2.2배~2.4배 및 2.4배~2.5배 정도 증가하였다.
4. 결 론
BAC 공정에서 EBCT 및 수온변화에 따른 에스트로겐류 4종에 대한 생물분해 제거특성을 조사한 결과, 다음과 같은 결론을 얻을 수 있었다.
1) 생물활성탄 공정에서 에스트로겐류 4종의 생물분해율은 EBCT와 수온에 따라 큰 영향을 받았으며 EBCT와 수온이 증가할수록 생물분해율이 증가하였다.
2) 에스트로겐류의 4종의 생물분해능은 E2가 가장 높았으며, 다음으로 E1, EE2 및 E3로 평가되었다.
3) 에스트로겐류의 4종에 대한 BAC 공정에서의 생물분해 속도상수(kbio)는 수온 5℃에서 25℃로 상승하였을 경우, 0.1729~0.2511 min-1에서 0.3833~0.6094 min-1로 2.2배~2.4배 정도 증가하였다.
Fig. 1.
Schematic diagram of BAC and biofilter system. 
Fig. 2.
Biodegradation of 4 estrogens using batch test (temp. : 20℃). 
Fig. 3.
Total ion chromatograms after biodegradation test using BAC and biofilter columns (water temp. : 25℃). 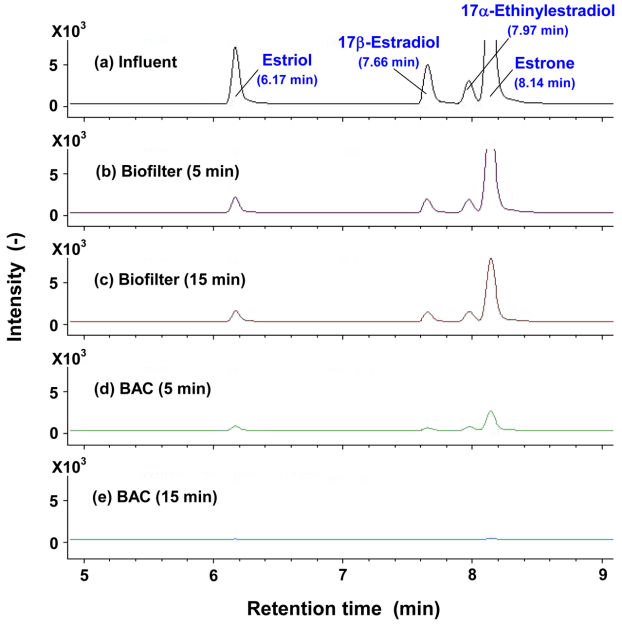
Fig. 4.
Proposed biotransformation pathway of 17β-estradiol (E2), 17α-ethinylestradiol (EE2) and estrone (E1) by bacteria [ 36~ 39] 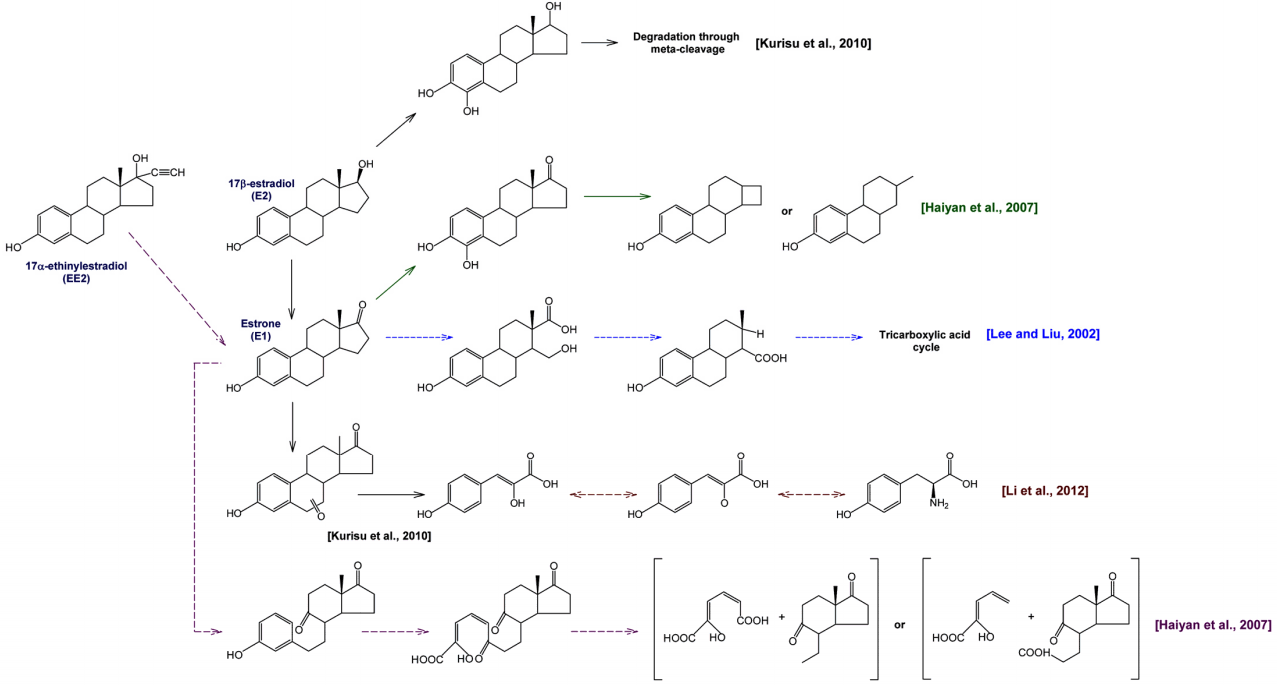
Fig. 5.
Biodegradation of 4 estrogens according to various EBCTs at 15℃. 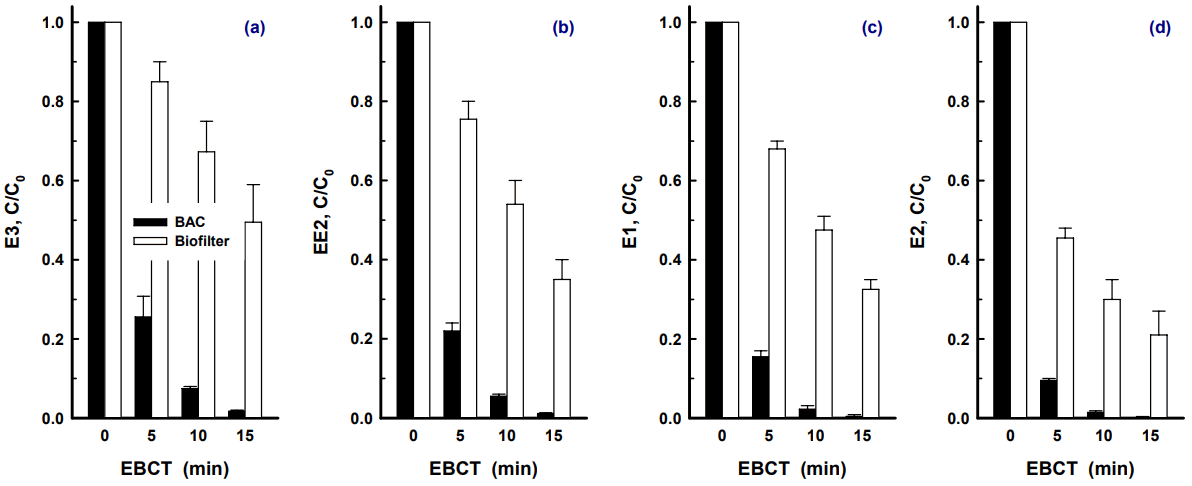
Fig. 6.
Biodegradation of E3 and E2 according to various water temperatures and EBCTs. 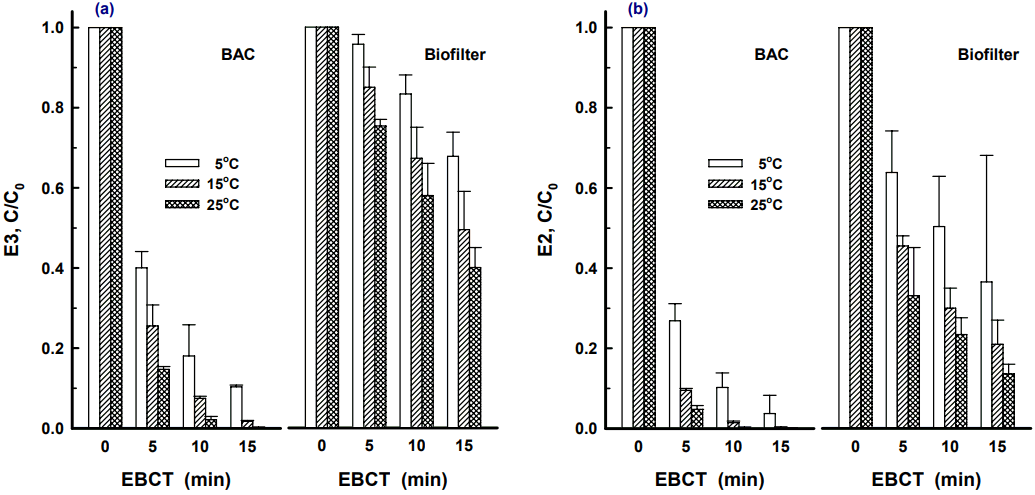
Table 2.
Characteristics of influent waters
|
pH
|
Turbidity
|
DOC
|
Temp
|
|
(-) |
(NTU) |
(mg/L) |
(℃) |
|
Influent water |
7.2~7.9 |
0.02~0.05 |
1.32~1.51 |
5~25 |
Table 3.
Average biomass and activity of attached bacteria in the BAC and biofilter columns
BAC
|
Biofilter
|
|
Biomass |
Activity (mg∙C/m3∙hr) |
Biomass (CFU/g) |
Activity (mg∙C/m3∙hr) |
|
1.2×108
|
2.99 |
5.4×106 |
1.92 |
Table 4.
Analytical conditions of online SPE-LC/MS-MS
|
Online SPE |
|
Online SPE cartridge |
PLRP-S (2.1×12.5 mm) |
|
Injection volume |
900 µL |
|
Flow rate |
1 mL/min |
|
Solvent |
A) Water: sampling loading and SPE cartridge conditioning |
|
B) ACN: SPE cartridge wash |
|
|
LC condition
|
|
|
Mobile phase |
A: 1 mM ammonium fluoride in water |
|
B: ACN |
|
Gradient program |
0 min, A/B = 90/10 |
|
2 min, A/B = 90/10 |
|
10 min, A/B = 0/100 |
|
11 min, A/B = 0/100 |
|
11.1 min, A/B = 90/10 |
|
14 min, A/B = 90/10 |
|
Flow |
0.3 mL/min |
|
|
MS-MS condition
|
|
|
Mode |
ESI, negative |
|
Capillary voltage |
ESI (-): 3.0 kV |
|
Gas temp. |
180℃ |
|
Gas flow |
16 L/min |
|
Nebulizer |
45 psi |
|
Sheath gas heater and flow |
300℃ and 11 L/min |
|
Type |
MRM (multiple reaction monitoring) |
|
Dwell |
30 ms |
Table 5.
MS/MS transition parameters of estrogens
|
Compounds |
Precursor ion
|
Product ion (Quan./Qual.)
|
Frag. voltage
|
Collision energy (Quan./Qual.)
|
|
(m/z) |
(m/z) |
(V) |
(V) |
|
estrone |
269.1 |
145/143 |
380 |
64/42 |
|
17β-estradiol |
271.1 |
143/145 |
380 |
66/46 |
|
estriol |
287.1 |
143/145 |
380 |
66/46 |
|
17α-ethinylestradiol |
295.1 |
143/145 |
380 |
66/46 |
|
17β-estradiol-13C3
|
274.4 |
1448.2/186.2 |
380 |
46/46 |
Table 6.
Average biodegradation rate constants (kbio) and half-lives (t1/2) for 4 estrogens biodegradation at various water temperatures and BAC materials
|
Condition |
Water temp. (℃) |
E3
|
EE2
|
E1
|
E2
|
|
kbio (min-1) |
t1/2 (min) |
kbio (min-1) |
t1/2 (min) |
kbio (min-1) |
t1/2 (min) |
kbio (min-1) |
t1/2 (min) |
|
BAC |
5 |
0.1729 |
4.01 |
0.1987 |
3.49 |
0.2287 |
3.03 |
0.2511 |
2.76 |
|
15 |
0.2697 |
2.57 |
0.3005 |
2.31 |
0.3733 |
1.86 |
0.4680 |
1.48 |
|
25 |
0.3833 |
1.81 |
0.4441 |
1.56 |
0.5351 |
1.30 |
0.6094 |
1.14 |
|
Biofilter |
5 |
0.0245 |
28.29 |
0.0396 |
17.50 |
0.0498 |
13.92 |
0.0695 |
9.97 |
|
15 |
0.0442 |
15.68 |
0.0610 |
11.36 |
0.0750 |
9.24 |
0.1242 |
5.58 |
|
25 |
0.0583 |
11.89 |
0.0717 |
9.67 |
0.0894 |
7.75 |
0.1723 |
4.02 |
References
1. S.. Imai, J.. Koyama, K.. Fujii, Effects of 17 beta-estradiol on the reproduction of Java-Medaka (Oryzias Javanicus), a new test fish species, Mar. Pollut. Bull., 51(8-12), 708-714(2005).  2. S. D.. Kim, J.. Cho, I. S.. Kim, B. J.. Vanderford, S. A.. Snyder, Occurrence and removal of pharmaceuticals and endocrine disruptors in South Korean surface, drinking, and waste water, Water Res., 41, 1013-1021(2007).  3. M. J.. Benotti, R. A.. Trenholm, B. J.. Vanderford, J. C.. Holady, B. D.. Stanford, S. A.. Snyder, Pharmaceuticals and endocrine disrupting compounds in US drinking water, Environ. Sci. Technol., 43, 597-603(2009).  4. L. D.. Arcand-Hoy, M. R.. Nimrod, D. E.. Hinton, Endocrine-modulating substances in the environment: Estrogenic effects of pharmaceuticals products, Int’l. J. Toxicol., 17, 139-158(1998).  5. S.. Jobling, C. L.. Tyler, Endocrine disruption in wild freshwater fish, Pure Appl. Chem., 75, 2219-2234(2003).  6. E. F.. Orlando, A. S.. Kolok, G. A.. Binzcik, J. L.. Gates, M. K.. Horton, C. S.. Lambright, E. L.. Gray, A. M.. Soto, L. J.. Guillette, Endocrine-disrupting effects of cattle feedlot waste water on aquatic sentinel species, the fathead minnow, Environ. Health Perspect., 112, 353-358(2004).  7. P. T. C.. Harrison, P.. Holmes, C. D. N.. Humfrey, Reproductive health in humans and wildlife: Are adverse trends associated with environmental chemical exposure?, Sci. Total Environ., 205, 97-106(1997).  8. M.. Coleman, H, M. I.. Abdullah, B. R.. Eggins, F. L.. Palmer, Photocatalytic degradation of 17β-oestradiol, oestriol and 17α-ethyniloestradiol in water monitored using fluorescence spectroscopy, Appl. Catal. B., 55, 23-30(2005).  9. US EPA, Drinking Water Contaminant Candidate List 3(2011).
10. S. K.. Khanal, B.. Xie, M. L.. Thompson, S.. Sung, S.. Ong, J. H. V.. Leeuwen, Fate, transport, and biodegradation of natural estrogens in the environment and engineered systems, Environ. Sci. Technol., 40, 6537-6546(2006).  11. S.. Zhao, P.. Zhang, M. E.. Melcer, J. F.. Molina, Estrogens in streams associated with concentrated animal feeding operations in upstate New York, USA, Chemosphere., 79, 420-425(2010).  12. A.. Sarmah, G. L.. Northcott, F. D. L.. Leusch, L. A.. Tremblay, A survay of endocrine disrupting chemicals (EDCs) in municipal sewage and animal waste waters in the Waikato Region of New Zealand, Sci. Total Environ., 355, 135-144(2006).  13. S.. Arnon, O.. Dahan, S.. Elhanay, K.. Cohen, L. S.. Shore, Transport of testosterone and estrogen from dairy-farm waste lagoons to groundwater, Environ. Sci. Technol., 42, 5521-5526(2008).  14. M. G.. Maniero, D. M.. Bila, M.. Dezotti, Degradation and estrogenic activity removal of 17β-estradiol and 17α-ethinylestradiol by ozonation and O2/H2O2, Sci. Total Environ., 407, 105-115(2008).  15. Z. H.. Liu, K.. Yoshinori, M.. Satoshi, Removal mechanisms for endocrine disrupting compounds (EDCs) in wastewater treatment-physical means, biodegradation, and chemical advanced oxidation: A review, Sci. Total Environ., 407, 731-748(2009).  16. Y.. Yoon, P.. Westerhoff, S. A.. Snyder, E. C.. Wert, J.. Yoon, Removal of endocrine disrupting compounds and pharmaceuticals by nanofiltration and ultrafiltration membranes, Desalination., 202(1-3), 16-23(2007).  17. J. L.. Cartinella, T. Y.. Cath, M. T.. Flynn, G. C.. Miller, K. W.. Hunter, A. E.. Childress, Removal of natural steroid hormones from wastewater using membrane contactor processes, Environ. Sci. Technol., 40, 7381-7386(2006).  18. M. J.. Benotti, B. D.. Stanford, E. C.. Wert, S. A.. Snyder, Evaluation of a photocatalytic reactor membrane pilot system for the removal of pharmaceuticals and endocrine disrupting compounds from water, Water Res., 43, 1513-1522(2009).  19. K. M. S.. Hansen, H. R.. Andersen, A.. Ledin, Ozonation of estrogenic chemicals in biologically treated sewage, Water Sci. Technol., 62, 649-657(2010).  20. Y. P.. Zhang, J. L.. Zhou, Removal of estrone and 17 beta-estradiol from water by adsorption, Water Res., 39, 3991-4003(2005).  21. T.. Fukuhara, S.. Iwasaki, M.. Kawashima, O.. Shinohara, I.. Abe, Adsorbability of estrone and 17 beta-estradiol in water onto activated carbon, Water Res., 40, 241-248(2006).  22. F. S.. Li, R.. Desmiarti, A.. Yuasa, A.. Horio, Behavior of natural estrogens in semicontinuous activated sludge biodegradation reactors, Bioresour. Technol., 99, 2964-2971(2008).  23. Z.. Li, B.. Dvorak, X.. Li, Removing 17β-estradiol from drinking water in a biologically active carbon (BAC) reactor modified from a granular activated carbon (GAC) reactor, Water Res., 46, 2828-2836(2012).  24. S.. Weber, P.. Leuschner, P.. Kampfer, W.. Dott, J.. Hollender, Degradation of estradiol and ethinyl estradiol by activated sludge and by a defined mixed culture, Appl. Microbiol. Biotechnol., 67(1), 106-112(2005).  25. J.. Shi, S.. Fujisawa, S.. Nakai, M.. Hosomi, Biodegradation of natural and synthetic estrogens by nitrifying activated sludge and ammonia-oxidizing bacterium Nitrosomonas Europaea, Water Res., 38, 2323-2330(2004).  26. H. J.. Son, S. J.. Yoo, J. S.. Roh, P. J.. Yoo, Biological activated carbon (BAC) process in water treatment, J. Korean Soc. Environ. Eng., 31(4), 308-323(2009).
27. F. S.. Li, A.. Yuasa, A.. Obara, M.. Alexander, Aerobic batch degradation of 17β-estradiol (E2) by activated sludge: Effects of spiking E2 concentrations, MLVSS and temperatures, Water Res., 39, 2065-2075(2005).  28. D. W.. Kolpin, E. T.. Furlong, M. T.. Meyer, E. M.. Thurman, S. D.. Zaugg, L. B.. Barber, H. T.. Buxton, Pharmaceuticals, hormones, and other organic waste contaminants in U.S. streams, 1999~2000: A national reconnaissance, Environ. Sci. Technol., 36, 1202-1211(2002).  29. H. J.. Son, S. W.. Kang, H. S.. Yoom, D. C.. Ryu, M. G.. Cho, Evaluation of biodegradation kinetic in biological activated carbon (BAC) process for drinkinf water treatment: Effects of EBCT and water temperature, J. Korean Soc. Environ. Eng., 37(7), 404-411(2015).  30. S.. Goel, R. M.. Hozalski, E. J.. Bouwer, Biodegradation of NOM: Effect of NOM source and ozone dose, J. Am. Water Works Assoc., 87(1), 90-105(1995).  31. T.. Hashimoto, T.. Murakami, Removal and degradation characteristics of natural and synthetic estrogen by activated sludge in batch experiments, Water Res., 43, 573-582(2009).  32. C. P.. Yu, H.. Roh, K. H.. Chu, 17 beta-estradioldegrading bacteria isolated from activated sludge, Environ. Sci. Technol., 41, 486-492(2007).  33. H. J.. Son, J. K.. Lee, S. G.. Kim, H. G.. Park, E. Y.. Jung, Removal characteristics of geosmin and MIB in BAC process: biodegradation and adsorption, J. Korean Soc. Environ. Eng., 39(6), 318-324(2017).  34. B.. Pauwels, K.. Wille, H.. Noppe, H.. de Brabander, T.. van de Wiele, W. and Boon N.. Verstraete, 17α-ethinylestradiol cometabolism by bacteria degrading estrone, 17β-estradiol and estriol, Biodegradation., 19, 683-693(2008).  35. J. S.. Vader, C. G.. van Ginkel, F. M. G. M.. Sperling, J.. de Jong, W.. de Boer, J. S.. de Graaf, M.. van der Most, P. G. W.. Stokman, Degradation of ethinyl estradiol by nitrifying activated sludge, Chemosphere., 41, 1239-1243(2000).  36. T.. Yoshimoto, F.. Nagai, J.. Fujimoto, K.. Watanabe, H.. Mizukoshi, T.. Makino, K.. Kimura, H.. Saino, H.. Sawada, H.. Omura, Degradation of estrogens by Rhodococcus zopfii and Rhodococcus equi isolates from activated sludge in wastewater treatment plants, Appl. Environ. Microbiol., 70, 5283-5289(2004).  37. R.. Haiyan, J.. Shulan, N.. ud din Ahmed, W.. Dao, C.. Chengwu, Degradation characteristics and metabolic pathway of 17α-ethinylestradiol by Sphingobacterium sp. JCR5, Chemosphere., 66, 340-346(2007).  38. F.. Kurisu, M.. Ogura, S.. Saitoh, A.. Yamazoe, O.. Yagi, Degradation of natural estrogen and identification of the metabolites produced by soil isolates of Rhodococcus sp. and Sphingomonas sp, J. Biosci. Bioeng., 109(6), 576-582(2010).  39. Z.. Li, R.. Nandakumar, N.. Madayiputhiya, X.. Li, Proteomic analysis of 17β-estradiol degradation by Stenotrophomonas maltophilia, Environ. Sci. Technol., 46, 5947-5955(2012).  40. H. B.. Lee, D.. Liu, Degradation of 17β-estradiol and its metabolites by sewage bacteria, Water Air Soil Pollut., 134, 353-368(2002).  41. H. J.. Son, C. W.. Jung, Y. I.. Choi, S. H.. Jang, Characteristics of biodegradation of geosmin using BAC attached bacteria in batch bioreactor, J. Korean Soc. Environ. Eng., 32(7), 699-705(2010).
42. H. J.. Son, J. T.. Choi, S. J.. Son H. S. and Lee, Analysis of attached bacterial communities of biological activated carbon process using DGGE method, J. Korean Soc. Environ. Eng., 34(8), 533-540(2012).  43. J. H.. Ko, H. J.. Son, Y. J.. Kim, S. M.. Bae, P. J.. Yoo, T. W.. Lee, Biodegradation characteristics of aldehydes using biological activated carbon process, J. Korean Soc. Environ. Eng., 31(11), 989-996(2009).
|
|