1. 서 론
최근 급격히 발달하고 있는 도시화와 산업화로 인한 인간 활동의 영향으로 지구온난화 및 화석연료 고갈이라는 환경문제가 대두됨에 따라 이를 대체하기 위한 신재생 에너지로서 바이오 연료가 각광받고 있다[1,2]. 국제에너지기구(International Energy Agency)의 보고에 의하면 연간 1.8%의 증가속도로 2005년에서 2030년까지 에너지 소요량이 55% 증가할 것으로 예측되었다[3]. 현재 사용되는 에너지원은 대부분이 화석연료이므로 온난화가스(greenhouse gas) 배출이라는 문제도 발생시킨다. 온난화가스 중 이산화탄소는 미세조류 배양에 사용이 되며 이를 통해 온난화가스 저감효과를 거두기도 한다[4~6].
미세조류(Microalgae)는 광합성 색소를 가지고 있어 태양광을 에너지원으로 사용하여 이산화탄소를 고정화하고 산소를 생산하는 기능을 가지고 있는 광독립영양미생물과 빛이 차단된 상태에서 유기물을 에너지원과 탄소원으로 이용하여 성장하는 종속영양미생물, 그리고 양쪽의 성질을 모두 가지는 혼합영양미생물로 크게 구분된다.
미세조류 배양을 통해 생산된 최종 산물인 Biomass는 동물 사료, 물고기 사료나 바이오 연료로 재사용함으로써 이산화탄소 저감과 대체연료 생산이라는 장점을 가지고 있다[7~10]. 미세조류를 이용하여 바이오매스를 생산하는 것은 다음과 같은 장점이 있다. 미세조류는 과거 수십 년 동안 많은 연구자들이 연구를 진행하였으며 30,000 종 이상이 연구가 완료되어 성장환경만 조절한다면 쉽게 원하는 미세조류를 배양할 수가 있다[11]. 미세조류의 lipids/oil 함량은 20-50%로서 비교적 높은 편이며 증식속도 또한 다른 육상식물에 비해 빠른 것으로 보고되었다[11]. 특히, 육상식물인 콩과 비교 시 동일 lipids/oil을 생산하는 데 필요한 부지는 49-132배 정도 작은 것으로 알려져 있다[12]. 바이오매스 외에 다른 유용물질들도 미세조류로부터 추출이 가능하며 이들 유용물질들은 화장품, 음식, 및 약 제조에 사용이 될 수 있다[12]. 미세조류를 배양하기 위해서는 인과 질소가 영양소로 필요한데 이는 하폐수에 포함된 인과 질소를 이용하여 배양하기도 한다. Kim 등[14,15]의 경우 미세조류를 이용하여 폐수내의 질소를 제거하기 위한 폐수처리 장치 개발을 시도하였다.
미세조류 배양 시 가장 중요한 요소는 빛, 이산화탄소(혹은 유기탄소), 그리고 인과 질소이다. 빛의 경우 인공배양 시 LED나 형광등을 이용하여 일정하게 제공을 할 수 있으며 이산화탄소는 배기가스, 순수 이산화탄소 혹은 공기 중에 포함된 이산화탄소를 공기펌프를 이용하여 제공할 수 있다. 광독립영양미생물의 배양에서는 이산화탄소가 탄소원으로 사용되는데 이 형식의 배양은 배양기간이 길고 바이오매스의 농도가 낮다는 단점을 가지고 있다. 이러한 단점을 해결하기 위해 혼합영양방식의 배양이 사용되기도 한다[16]. 이러한 방식의 배양에는 추가로 유기탄소를 투입하여 미세조류 배양의 탄소원으로 사용한다[17].
미세조류 배양의 중요한 요소인 질소의 경우 다양한 산화 상태를 가진 ammonium, nitrate, nitrite, molecular nitrogen과 유기질소인 urea, ammonium acetate, 그리고 peptides가 사용될 수 있다. 일반적으로는 nitrate가 주로 사용되지만 종에 따라 암모니아 계열의 질소가 성장에 더 효과적인 경우도 있으며 경우에 따라 urea가 특정 미세조류 성장에 최적의 질소원으로 판명된 경우도 있다[18].
따라서 본 연구에서는 공기를 이용하여 배지의 혼합을 용이하게 함으로써 Scenedesmus acuminatus의 성장에 필요한 빛의 이용율과 이산화탄소의 공급을 높이고자 하였다. Scenedesmus acuminatus의 배양에서 일반 공기 주입과 순수 이산화탄소의 공급의 효과를 비교하였으며 고농도 인과 질소의 주입 시 Scenedesmus acuminatus의 성장에 미치는 영향도 분석하였다. 또한 유기탄소원인 아세테이트가 Scenedesmus acuminatus의 성장에 미치는 영향도 밝히고자 하였다.
2. 실험재료 및 방법
2.1. 사용 미세조류 및 배지
본 연구에 사용된 미세조류는 Scenedesmus acuminatus (LIMS-PS-1973)로 한국해양미세조류은행(KMMCC, Korea)로부터 분양받았다. 사용된 배지는 Table 1에 나타낸 바와 같은 성분의 JM배지(Jaworski's Medium)와 고농도 인과 질소 및 아세테이트를 포함한 인공배지를 조제하여 121℃에서 15분간 멸균하여 사용하였다.
2.2. 실험 장치
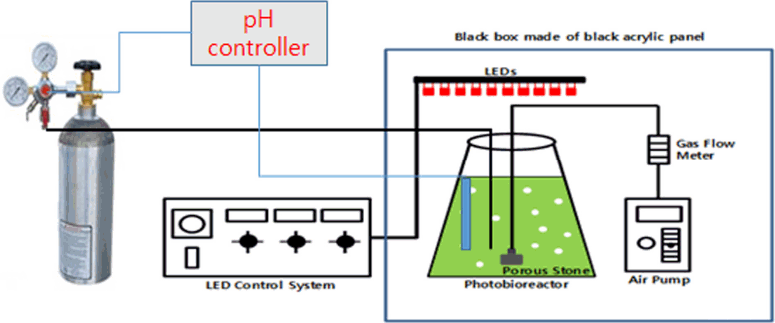
Scenedesmus acuminatus의 성장 실험은 공기 공급 속도에 따른 성장 속도를 비교하기 위해서 에어 펌프를 이용하여 공기의 공급 속도를 0.0 vvm~1.28 vvm의 범위로 달리 하였다. 광원으로는 660 nm 파장으로 발광하는 적색 LED를 사용하였는데 이는 Lee 등[19]의 연구에서 녹색계통의 조류의 배양에는 적색 LED를 사용하였을 때 가장 우수하다고 보고하였기 때문이다. 반응기는 가로 60 cm, 세로 60 cm, 높이 30 cm의 크기로 반응시스템을 제작하였으며 LED 램프는 S-tech LED사로부터 bar 형식의 LED램프를 구입하여 실험하였다. 광원은 반응기의 상부에 설치하여 위에서 아래로 광을 공급하였다. 조도 및 광량은 조도 2,260 lux, 38 µmol/m2 /s로 하였으며, 조도계(I-346 Illuminometer, Sekonic Co., Philippines)와 광량계 (MQ-306, Apogee Instruments. Inc., Logan, UT)를 사용하여 측정하였다. 반응시스템은 Fig. 1과 같이 구성되었으며 반응조건에 따라 배양조의 크기는 1000-3,000 mL로 변경하여 사용하였다.
CO2 주입 실험의 경우 하루에 8번 CO2를 분사하는 것으로 파악되었으며 일회 분사 시 약 30 mL의 CO2가 반응조에 유입되었다.
2.3. 미세조류 배양 방법 및 농도 측정
Scenedesmus acuminatus의 성장특성 연구는 배양기로 100-500 mL 용량의 코니칼 비이커를 사용하여 희석한 초기배양액을 주입하여 계획한 초기농도로 맞춘 후 파라필름을 이용해 비커의 입구를 막은 후 미세 구멍을 뚫어 주었다. 공기 공급 속도 따른 성장 속도를 비교하기 위하여 반응기의 바닥 부분에 산기석(porosity)을 고정시켜 에어펌프를 조정하여 공급 속도를 조절하였다. 이산화탄소를 투입하는 경우에는 이산화탄소 탱크와 연결된 pH 조절장치를 이용하여 일정 pH 이상일 경우 자동적으로 이산화탄소를 반응조에 주입하여 pH를 조절하였다. 온도조절은 실험실에 설치된 온도 조절장치를 이용하여 반응기의 온도를 21~23℃로 일정하게 유지하였다. 배양액의 온도는 수은온도계를 이용하여 측정하였다.
반연속 배양은 바이오매스의 농도가 최대치에 도달하였을 때, 용액의 일부를 새로운 배지로 희석하여 배양하는 방법이다. 새로운 용액으로의 치환정도를 나타내는 식은 다음과 같이 표시한다. 여기서, D는 치환율, Vr은 반응기에서 운전되고 있는 배양액의 부피, Vn은 치환된 용액의 부피를 의미한다.
미세조류의 성장은 UV 흡광광도계(UV-vis Spectrophotomter SP 3000, Optima, Tokyo)를 이용하여 약 2 mL의 샘플을 취한 후 660 nm 파장에서 흡광도를 측정하여 관찰하였다. 미세조류 바이오매스양(g/L)과 흡광도의 관계는 흡광도 측정 후 샘플을 원심분리기에 넣어 고액분리하고 냉동건조한 후 측정된 바이오매스량을 이용하여 구하였다.
2.4. 미세조류 비증식속도와 최대 바이오매스 생산성
주어진 배양 조건에서의 Scenedesmus acuminatus의 비증식속도(specific growth rate)는 다음의 식으로 계산하였다.
여기서, µmax는 비증식속도(day-1), N1 및 N2는 초기(t=0) 및 일정 배양 시간 후의 Scenedesmus acuminatus의 최대 농도(g/L), 그리고 t는 배양 시간(day)을 나타낸다.
최대바이오매스 생산성(maximum biomass productivity)은 다음의 식으로 계산하였다.
여기서, Pmax는 최대 바이오매스 생산성(g/L/day), Xt는 최종 배양시간(tx)에 측정된 바이오매스의 농도를 의미한다.
2.5. 질소 및 인 농도 측정
배지 내 Scenedesmus acuminatus의 성장에 필요한 성분인 질소와 인의 농도 변화를 분석하기 위해 COLORIMETER (DT/870, Hach, U.S.A.)를 사용하여 분석하였다. 질소 측정에서는 배지의 질소원으로 nitrate가 사용되었으므로 NO3--N (method 10020)를 측정하였고, 인의 경우 phosphate가 사용되었으므로 PO4 3- (method 8114)을 측정하였다. NO3 - -N와 PO4 3-의 측정 시 각각의 측정 농도는 0~30.0 mg/L, 0~45.0 mg/L였고 오차 범위는 ±0.5 mg/L, ±0.1 mg/L였다.
3. 실험결과 및 해석
3.1. 공기 공급 속도의 영향
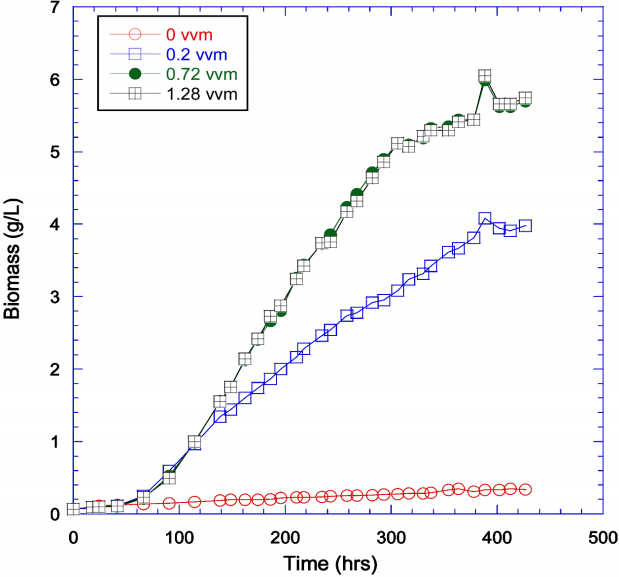
조도 2,260 lux에서 공기 공급 속도를 0, 0.2, 0.72, 그리고 1.28 vvm의 범위로 달리하여 실험하였으며, 사용배지는 JM이었다. Scenedesmus의 성장 곡선은 Fig. 2에 나타나있다.
실험조건, 비성장속도, 최대 바이오매스 생산성 결과는 Table 2에 요약하였다. 초기 바이오매스의 농도는 0.066-0.068 g/L로 일정하게 맞추었다. 비성장속도는 0.72 vvm에서 0.302 d-1로 가장 높았으며, 최대 바이오매스 생산성은 0.72 vvm과 1.28 vvm에서 거의 동일한 0.317, 0.319 g L-1 d-1 값으로 가장 높았다. 이 결과는 Tetraselmis suecica 배양실험에서의 최적 공기주입량과 흡사하였다[20]. 최대 바이오매스 농도도 0.72와 1.28 vvm일 때 5.69와 5.74 g/L로 가장 높았으며, 공기를 주입하지 않았을 경우 0.34 g/L로 최소값을 보여주었다. 공기 공급 범위 중 다른 공기 공급 속도보다 비교적 낮은 0.2 vvm의 경우 혼합에 의한 효과가 타 공기공급 실험보다 낮은 것을 알 수 있었다. 공기 공급을 해주지 않은 경우는 0.72 vvm의 경우보다 비성장속도의 경우 30배 이상 적었으며 최대 바이오매스 생산성의 경우 20배 이상 적은 값을 나타내었다. 이는 공기공급을 하지 않을 경우에는 공기중의 이산화탄소 공급 부족 및 그림자효과(mutual shading)에 의해 빛이 효과적으로 전달되지 않았기 때문으로 판단된다[20].
3.2. 아세테이트 공급의 영향
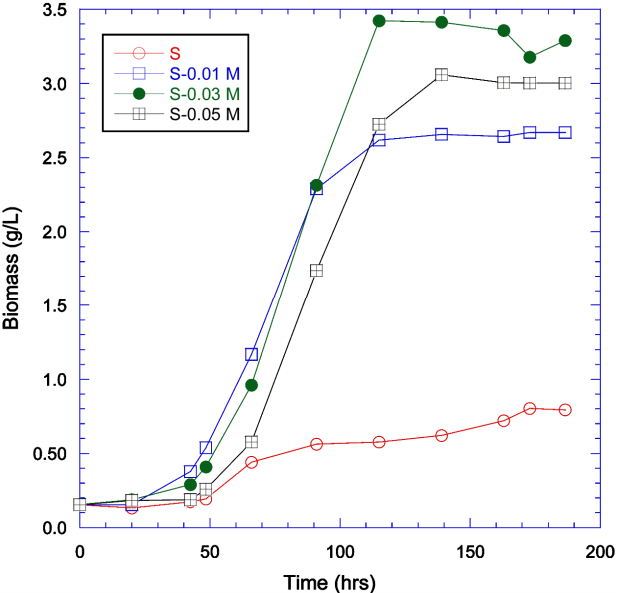
아세테이트 공급이 Scenedesmus의 성장에 미치는 영향을 보기 위해 100 mL 플라스크에 일정량의 Scenedesmus와 암모니움 아세테이트를 주입하여 배양하였다. 공기공급은 없었으며 아세테이트의 농도는 0, 0.01, 0.03, 그리고 0.05 M로 조절하였다. 초기 바이오매스의 농도는 0.153-0.156 g/L로 하였다. 아세테이트 주입량에 따른 Scenedesmus의 성장 곡선은 Fig. 3에 나타나있다.
공기를 주입하지 않은 경우에는 비성장속도는 0.32 d-1이었고 최대 바이오매스 생산성은 0.08 g L-1 d-1이었다. Fig. 2를 보면 공기를 주입하지 않은 경우의 비성장속도는 0.069 d-1이었고 최대 바이오매스 생산성은 0.015 g L-1 d-1였는데 이는 공기주입 실험 시 사용한 반응조는 500 mL였고 아세테이트 주입 시 사용한 반응조는 100 mL로써 같은 조건일지라도 반응조의 크기 차이로 인해 광흡수효율이 달라 성장속도가 다른 것으로 판단되었다[19]. 주입한 아세테이트의 농도가 증가함에 따라 비성장속도와 최대 바이오매스 생산성 모두 크게 증가하는 것으로 확인이 되었다. 0.03 M 아세테이트 주입 실험의 경우 비성장속도는 0.82 d-1이었고 최대 바이오매스 생산성은 0.56 g L-1 d-1로 아세테이트 주입 실험 결과 중 최대치를 나타내었다. Scenedesmus 의 경우 혼합영양미생물로 분류가 되기 때문에 광조건하에서는 광합성을 통해 성장을 하고 개체수가 증가하여 광흡수 저해현상이 발생할 때에는 유기물을 탄소원과 에너지원으로 사용하여 성장을 할 수 있기 때문에 아세테이트를 주입하였을 때 고농도에서 빛 공급에 지장이 있더라도 성장이 지체되지 않고 이를 에너지원으로 사용하여 성장을 한 것으로 판단된다. Sarat Chandra 등[21]의 실험에서도 acetate의 공급에 따른 Scenedesmus obtusus의 성장특성에 대해 연구하였는데 여러 질소원 중에서 ammonium acetate의 주입이 미세조류의 성장을 가장 크게 증진시킨 것으로 보고되었다.
3.3. Scenedesmus의 반연속 배양 특성
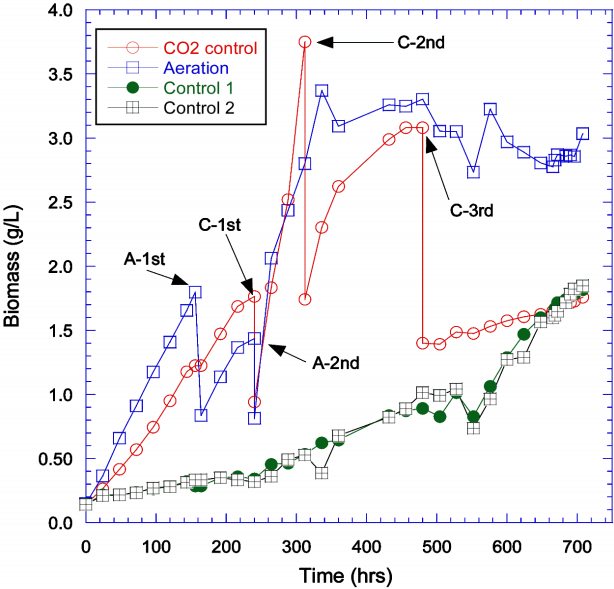
반연속 배양은 인공배지를 사용하였고 4개의 3 L 용량의 반응조를 준비하여 첫 번째 반응조는 pH 조절기 및 CO2 분사기를 설치하였고 두 번째 반응조에는 에어펌프를 설치하여 0.2 vvm의 속도로 공기를 공급하였다. 나머지 두 개의 반응조는 공기공급과 CO2 공급이 없는 상태의 비교값을 얻기 위해 설치하였다. 배양에 사용된 광의 세기는 3,000 lux로 일정하게 유지하였다. 반연속 배양 시 Scenedesmus의 성장곡선은 Fig. 4에 도시하였고 결과 값은 Table 3에 요약하였다.
control에서 배양된 Scenedesmus의 경우 다른 실험과 비교 시 가장 낮은 비성장속도(0.085 d-1)와 최대 바이오매스 생산성(0.057 g L-1 d-1) 값을 나타내었다. 배치 실험에서 공기 공급이 없는 실험값(비성장속도: 0.069 d-1, 최대 바이오매스 생산성: 0.015 g L-1 d-1)과 비교하면 비성장속도의 경우 유사한 값을 보였으나 최대 바이오매스 생산성은 4배 정도 높은 값을 보여주었다.
공기 주입 실험의 경우 CO2 주입 실험에 비해 초기 성장은 빠른 것으로 판명되었다. 빠른 초기 성장으로 인해 배지로 사용된 JW 용액의 인과 질소가 모두 소진이 되었기 때문에 A-1st 단계에서 JW 배지로 50% 치환을 해주었다. 이 후 CO2 주입 실험의 인과 질소가 모두 소진 되는 단계(C-1st)에서 고농도 인과 질소 및 암모니움 아세테이트를 포함한 배지로 두 반응조의 용액을 50%로 각각 치환하였다. 이 치환과정 후의 미세조류는 급격히 성장하는 것이 확인되었고 두 실험 모두에서 최대치의 미세조류 농도를 얻을 수 있었다. 공기 주입 실험의 경우 미세조류 농도가 최대치에 도달한 후 더 이상 증가하지 않았다. CO2 주입 실험에서는 최대 농도에 도달한 후 한차례 더 50% 치환을 실시하였는데 성장률은 첫 번째 치환 후의 성장률에 비해 감소하였으며 이후 한차례 더 50% 치환을 실시하였으나 이후 성장률은 급격히 감소하는 것을 확인하였다. CO2 주입 실험에서 첫 번째 치환 시 주입된 아세테이트의 농도는 0.05 M이었고(공기 주입 실험에서는 첫 번째 치환은 JM배지를 이용하였고 두 번째 치환에서 아세테이트를 사용함) 이 아세테이트 농도에서의 비성장속도는 0.460 d-1이며 최대 바이오매스 생산성은 0.936 g L-1 d-1이었다. 이 값은 배치실험의 비성장속도 0.70 d-1보다 적으나 최대 바이오매스 생산성 0.50 g L-1 d-1)에 비해서는 약 2배 정도 큰 값을 나타내고 있다. CO2 주입 실험에서 치환이 거듭될수록 성장이 지체되는 것은 치환 시 투입된 아세테이트의 농도가 누적되어 높아짐으로 인해 미세조류 성장에 저해요인으로 작용하는 것으로 판단된다[21].
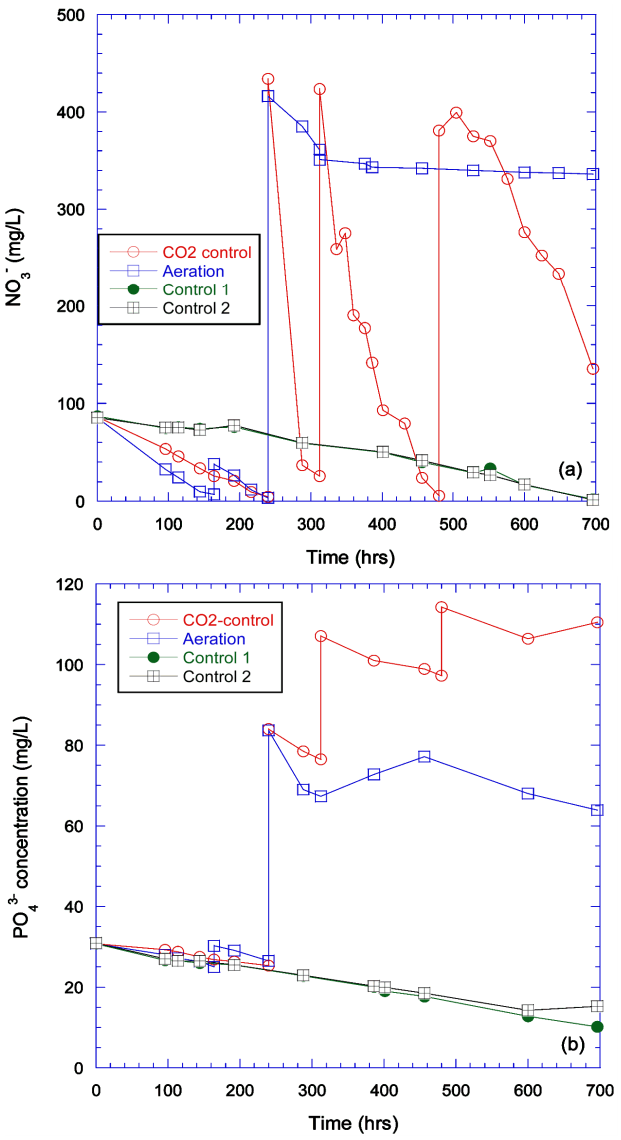
반연속 반응실험에서의 인과 질소의 농도변화는 Fig. 5에 표시하였다. Control 1과 2의 경우 인과 질소는 천천히 지속적으로 제거가 되는 것으로 파악되었다. 공기주입실험과 CO2 주입 실험의 경우 배양 초기에 미세조류가 급격하게 증가하여 인과 질소의 농도가 급격하게 소모되었다. 따라서 고농도 인질소 및 아세테이트 함유 배지를 50% 씩 치환하였고 두 반응조 모두 고농도의 인과 질소 농도를 나타내었다. 이 후 공기주입실험의 경우 질소는 일부 감소하다가 일정하게 유지되었고 인의 경우 초기에 급격히 감소한 후 이후 일정하게 유지되었다. 하지만 CO2 주입 실험에서는 인과 질소 모두 치환 후에 급격히 감소하는 것을 확인할 수 있었다. 두 번째 치환 후의 질소 농도 변화는 168시간 동안 423 mg/L에서 5.8 mg/L로 급격하게 감소하였다. 인의 경우는 같은 기간에 107 mg/L에서 97 mg/L로 감소하였다.
4. 결 론
본 연구에서는 Scenedesmus acuminatus의 효율적 배양을 위하여 공기공급에 따른 혼합효과와 적정한 혼합을 위한 공기 공급 속도를 선정하고 미세조류 배양에 일반적으로 사용되는 JM 배지에 인과 질소의 농도를 높이고 아세테이트를 첨가한 배지를 사용하여 성장특성을 살펴보았다. 공기를 주입 하지 않은 경우와 다양한 공기 공급 속도(0.2 vvm, 0.72 vvm, 1.28 vvm)의 조건에서 비성장 속도는 0.72 vvm의 공급 속도(0.302 d-1)에서 가장 높았으며, 공기를 주입하지 않은 경우(0.069 d-1) 보다 3배 이상 높은 것을 관찰할 수 있었다. JM 배지에 아세테이트를 첨가한 경우 0.03 M일 경우 최대 비성장속도(0.82 d-1)와 최대바이오매스 생산성(0.56 g L-1 d-1)을 보여주었다. 반연속배양에서는 CO2를 주입하여 pH를 7.5로 조절하였고 첫 번째 희석전까지의 비증식속도와 최대바이오매스 생산량은 0.25 d-1와 0.162 g L-1 d-1였다. 아세테이트와 고농도 인 및 질소를 포함한 JM 배지로 희석한 경우에는 비증식속도와 최대바이오매스 생산량은 0.460 d-1과 0.936 g L-1 d-1으로 급격히 증가하였다. 이후 희석이 진행될수록 비증식속도와 최대바이오매스 생산량은 지속적으로 감소하는 경향을 보였다. 공기주입 실험의 경우 일반 JM 배지를 사용하였을 때 가장 높은 비증식속도(0.381 d-1)와 최대바이오매스 생산량(0.253 g L-1 d-1)을 얻었으나 아세테이트를 포함한 배지로 치환하였을 경우 오히려 비증식속도와 최대바이오매스 생산량은 감소하였다. 본 연구결과를 통해 0.3 M의 아세테이트를 함유한 배지와 CO2를 적절하게 주입한다면 기존 배양법 보다 훨씬 효율적이고 경제적으로 Scenedesmus acuminatus를 배양할 수 있을 것으로 판단된다.