1. 서 론
낙동강 하류에 위치한 취수원은 매년 하절기에 남조류의 과다발생으로 인해 원수 중의 유기물질 농도뿐만 원수의 pH도 9.0 이상으로 매우 높게 유지된다. 이러한 원수의 성상은 정수처리 공정에서 사용되는 염소에 의해 소독부산물 생성을 증가시킨다. 염소 소독부산물 생성에 영향을 미치는 인자들로는 원수의 pH, 수온, 브롬이온 농도, 염소 투입 농도 및 접촉시간 그리고 수중의 유기물질 농도 및 특성 등이 있다[1~3]. 발생되는 염소 소독부산물의 대부분을 트리할로메탄류(trihalomethanes, THMs)와 할로아세틱엑시드류(haloacetic acids, HAAs)가 차지하며[4], 생성된 HAAs는 입상활성탄(granular activated carbon, GAC) 공정에서 흡착 또는 생물분해에 의해 거의 제거가 가능하지만 THMs는 난분해성으로 활성탄의 흡착능이 파과에 도달하면 제거가 불가능하다[5,6]. 따라서 정수처리 공정에서 THMs의 제어를 위해서는 THMs 생성에 관여하는 여러 인자들을 고려하여 생성조건을 조절하면 THMs의 생성을 줄일 수 있다.
정수처리에서 염소는 모래 또는 활성탄 여과공정 후단에 소독목적으로 투입하는 후염소 처리, 오염된 원수의 전처리 목적으로 염소의 강력한 산화력(소독 및 살조작용)을 이용하여 응집・침전공정 전단에 투입하는 전염소 처리 및 침전지와 모래 여과지 사이에 주입하는 중염소 처리가 있다. THMs 생성을 최소화하기 위해서는 중염소 처리를 하거나 후염소 처리만 하는 것는 가장 이상적이나, 오염된 원수를 사용하는 정수장에서는 암모니아성 질소 및 철 망간제거, 조류사멸, 침전성 개선 등을 위해 불가피하게 전염소를 사용하고 있다[7].
실제로 정수장에서는 전염소 처리의 목적 및 최초 설계 조건에 따라 취수구, 착수정, 혼화지 등 다양한 지점에 투입하고 있다. 전염소는 THMs의 전구물질인 유기물이 전혀 제거되지 않은 상태에서 주입되기 때문에 THMs 생성의 주요요인이다[5,6]. 그리고 전염소 주입 지점에 따라 염소와 수중에 잔존하는 유기물질이 접촉할 수 있는 시간이 달라지기 때문에 THMs 생성농도 또한 많은 차이를 나타낼 수 있다. 전염소를 취수장에 투입할 경우, 염소 처리된 원수가 정수장에 도달할 때까지지 긴 시간 동안 수중의 유기물질과 염소가 반응하여 많은 양의 THMs가 생성되는 문제점이 발생한다. 따라서 정수처리 공정에서 전염소 사용으로 인한 THMs 생성량을 저감시키기 위해서는 수중에 잔존하는 용존 유기물질과 염소 접촉시간을 최소화시켜 THMs 생성의 제어가 가능하다. 따라서 급속 혼화공정의 전단에 전염소를 투입할 경우, 응집-침전공정에서 용존성 유기물질의 많은 부분들이 제거되어 용존성 유기물질과 염소와의 접촉시간을 최대한 감소시킬 수 있다[8].
본 연구는 전 염소 처리를 하는 정수처리공정에서 THMs 생성량을 저감하기 위해 첫째, 취수구에서 황산이나 CO2를 주입하여 원수 pH를 저하시킨 후 염소를 투입하는 방안과 둘째로 전오존 후단에 염소를 투입하고 응집을 하는 두 가지 방안에 대한 THMs 생성 저감율을 조사하여 방안을 제시하고자 한다.
2. 실험 재료 및 방법
2.1. 실험 재료
2.1.1. 원수 성상
실험기간(2016년 4월~9월) 중의 낙동강 하류지역의 원수 성상을 Table 1에 나타내었다. 조류 농도(Chl-a)가 비교적 낮은 4월에는 전반적으로 수질 지표들이 양호하였으나 조류농도가 증가하는 8월과 9월에는 pH, DOC와 UV254의 농도가 증가하는 것으로 나타났다.
2.1.2. 정수처리 공정 및 전염소 투입지점
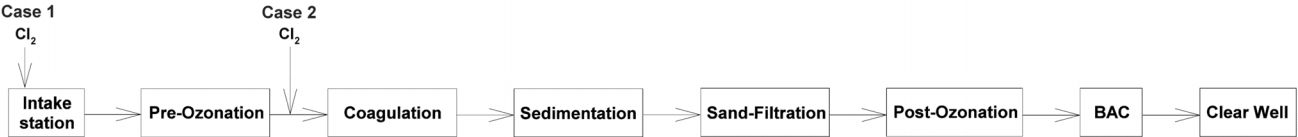
낙동강 하류에 위치한 대규모 정수장들의 정수처리 공정은 Fig. 1에서 볼 수 있듯이 취수장, 전오존, 응집, 침전, 여과, 후오존, 입상활성탄 여과지 및 정수지로 구성되어 있다. 취수장에서 전염소를 투입하는 case 1의 경우, 원수에 함유된 유기물질이 저감되지 않은 상태에서 염소가 투입되어 수중에 잔존하는 유기물질과 긴 접촉시간을 가지며 정수공정으로 유입된다. 따라서 THMs 생성을 가장 많이 유발할 수 있는 지점이며, 산(acid)을 주입하여 pH 저하에 따른 THMs 생성량의 저감율을 조사하였다.
Case 2는 전오존 공정 후단 및 응집제 주입 전 단계에 전염소를 투입하는 경우로 수중의 유기물질 농도 및 염소와의 접촉시간이 case 1에 비해 상대적으로 감소한다. 따라서 오존 처리에 의한 유기물질 성상변화 및 응집-침전공정에 의한 유기물질 농도 감소에 따른 THMs 생성량 저감율을 조사하였다.
2.2. 실험 방법
2.2.1. pH 변화가 THMs 생성에 미치는 영향
원수 수온을 20℃와 30℃ 조절한 후 황산(1 + 10)과 4 NNaOH를 사용하여 원수의 pH를 8.0과 9.5로 조정한 후 초순수에 염소가스를 포집하여 제조한 염소수(염소농도 : 4,000 mg/L)를 사용하여 각각의 시료에 염소를 5 mg/L의 농도를 주입하여 온도를 20℃와 30℃로 설정한 항온배양기에 보관하면서 시간경과에 따라 시료를 채취하여 THMs를 분석하였다.
취수장에서 황산 주입을 통한 pH 감소에 따른 THMs 생성모의실험을 위하여 취수원수에 황산(1 + 10)과 4 N-NaOH를 주입하여 pH를 7.0, 8.0, 9.0 및 9.5로 맞추고 염소수(염소농도 : 4,000 mg/L)를 사용하여 각각의 시료에 염소를 4 mg/L의 농도를 주입한 후 시간 경과에 따라 THMs 생성량을 조사하였으며, 염소수 주입 후 변화된 pH를 측정하였다.
2.2.2. 오존처리가 THMs 생성에 미치는 영향
낙동강 하류원수에 오존을 0, 0.5, 1.0, 1.5, 2.0 mg/L로 주입한 후 각각의 시료를 2 L 채취하여 각각의 시료에 염소수(염소농도 : 4,000 mg/L)를 염소농도 3 mg/L의 농도로 주입하여 혼합시킨 후 시간경과에 따라 시료를 채수하여 THMs를 분석하였다. 또한, 오존처리된 각각의 시료수에 대해 유기물 특성분석도 함께 수행하였다. 오존처리는 300 m3/일 처리규모 pilot-plant의 전오존 처리공정에서 수행하였고, diffuser방식으로 체류시간은 5분이었다.
2.2.3. 응집처리가 THMs 생성에 미치는 영향
낙동강 하류원수에 오존을 1.0 mg/L의 농도로 처리한 후 jar-tester에서 염소수(염소농도 : 4,000 mg/L)를 염소농도 2.5 mg/L의 농도로 주입하여 혼합시킨 후 응집제(alum)를 40 mg/L의 농도로 주입하고 급속교반 150 rpm으로 1분, 완속교반 60 rpm으로 15분으로 수행하였다. 시간의 경과에 따라 시료를 채취하여 THMs 및 유기물 특성분석을 하였다.
2.2.4. 분석
THM 분석은 Na2S2O3로 잔류염소를 고정시킨 후 head-space auto sampler가 장착된 GC/μECD (Agilent 6890 N, U.S.A.)를 사용하여 분석하였다.
수중의 용존 유기물질 농도 및 유기물 특성분석에는 LC-OCD (Model 8, DOC-Labor, Germany) 시스템을 이용하였다. LC-OCD 시스템은 size exclusion chromatography (SEC) 컬럼(Toyopearl TSK HW-50S, 250 × 20 mm) 및 ultraviolet detector (UVD), organic carbon detector (OCD)가 장착되어 있어 수중에 혼재되어 있는 NOM을 5개의 그룹(biopolymer, humic substances, building block, low molecular weight (LMW) acids 및 LMW neutrals)으로 분류하여 정성・정량이 가능하다. SEC 컬럼에서의 분류가능한 분자량 범위는 100~10,000 Da 범위이다[9]. 분석을 위해 시료수 1,000 μL를 주입하였으며, 이동상으로는 phosphate buffer (2.5 g KH2PO4 + 1.5 g Na2HPO4・2H2O to 1 L DW, Fluka)를 사용하였고 1.1 mL/min의 유량 조건으로 분석하였다. 산화제(4 mL phosphoric acid (Fluka) + 0.5 g potassium peroxodisulfate (Fluka) to 1 L DW)를 주입하여 Gräntzel thin film reactor에서 유기물질을 완전 산화시키며, 정량한계는 10 μg・C/L이다[9].
3. 결과 및 고찰
3.1. pH와 수온이 THMs 생성에 미치는 영향
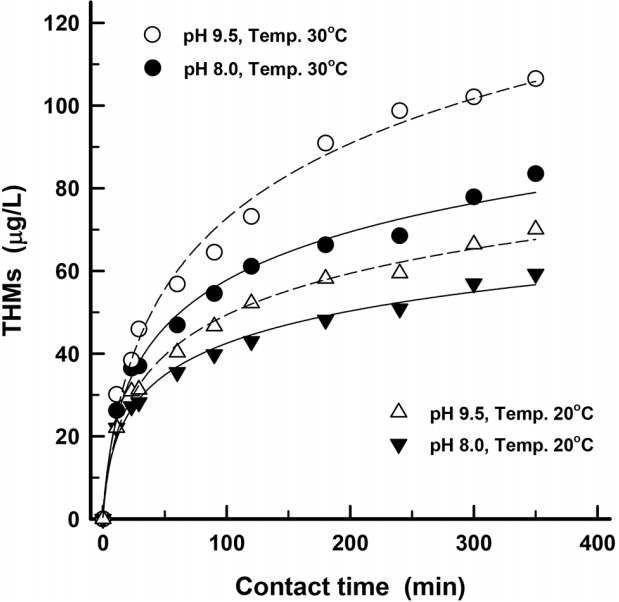
원수의 수온 및 pH 변화에 따른 THMs 생성농도 변화를 접촉시간에 따라 평가한 것을 Fig. 2에 나타내었다.
수온 20℃, pH 8.0의 조건에서 염소 투입 350분 경과 후 THMs 생성농도는 59 μg/L였으며, 동일한 수온에서 pH를 9.5로 상승시킨 경우에서는 70 μg/L로 나타나 THMs 생성농도는 18.6% 정도 증가하였다. 또한, 원수의 수온이 30℃로 상승된 조건에서는 염소 투입 350분 경과 후, pH 8.0 및 pH 9.5인 원수시료에서 THMs 생성농도가 각각 84 μg/L 및 107 μg/L로 나타나 pH 상승에 따른 THMs 생성농도는 27.4% 정도 증가하였다.
동일한 pH 조건에서 수온의 상승에 따른 THMs 생성농도 변화에서는 pH 8.0의 경우는 20℃에서 30℃로 수온이 상승하면 염소 투입 350분 경과 후에 THMs 생성농도가 59 μg/L에서 84 μg/L로 증가하여 THMs 생성농도의 상승률은 42.4%로 나타났다. 또한, 원수의 pH가 9.5일 때는 THMs 농도가 각각 70 μg/L와 107 μg/L로 나타나 52.9% 정도의 THMs 농도 증가율을 보였다.
낙동강 하류의 원수를 이용하여 수온과 pH를 변화시켜 THMs 생성실험을 수행한 결과, 수온과 pH가 THMs 생성에 미치는 영향이 매우 큰 것을 알 수 있었다. 조류가 번성하는 하절기에 낙동강 하류 원수에서 pH와 수온이 급격히 상승하면 동일한 유기물 농도에서도 전염소 처리에 의해 생성되는 THMs 농도는 큰 폭으로 상승할 가능성을 가지고 있다. 수온은 인위적인 제어가 어려운 THMs 생성인자이나 pH는 제어가 용이한 인자임으로 THMs 생성을 저가시키기 위해 하절기에 원수의 pH를 저하시켜 전염소 처리를 하는 방안을 강구하였다.
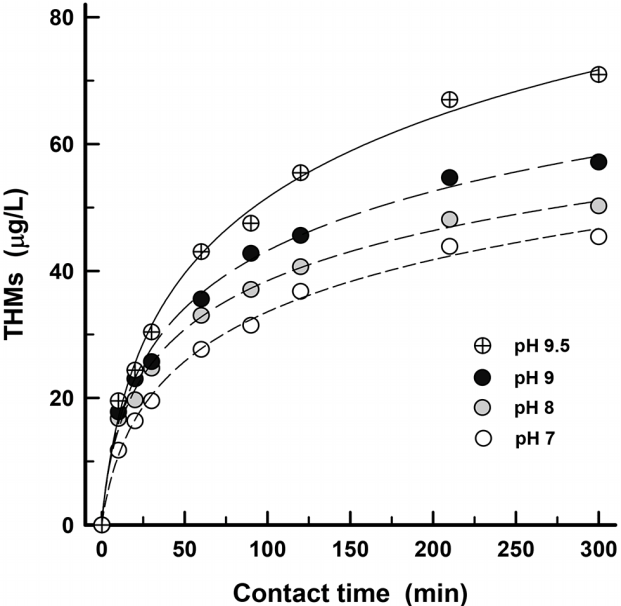
취수구에서 황산이나 CO2 투입을 통하여 pH를 저하시켜 전염소를 투입하는 경우의 THMs 생성율 저감효과를 모의하기 위해 수온 20℃의 원수 PH를 황산(1 + 10)을 사용하여 9.5, 9.0, 8.0, 7.0으로 조절한 후 염소를 4 mg/L의 농도로 주입하여 접촉시간 경과에 따른 THMs 생성농도 변화를 Fig. 3에 나타내었다.
원수의 pH를 9.5에서 9로 저하시켜 염소를 주입한 경우는 접촉시간 300분 경과 후의 THMs 생성농도를 비교해 보면 19.4% 정도 저감되었다. pH를 8과 7로 저하시킨 경우 THMs 생성농도의 저감율은 각각 29.3% 및 36.1%로 나타났다. 또한, 원수의 pH가 9일 때 pH를 8로 저하시켜 염소를 투입한 경우의 THMs 생성농도 저감율은 14%, 원수의 pH를 8에서 7로 저하시킨 경우에는 9.5% 정도의 THMs 생성농도 저감율을 나타내었다. pH는 화학적으로 소독부산물 생성에 중요한 인자로 THMs 구성종 중에서 CHCl3는 다른 구성종들에 비해 pH와 밀접한 상관성을 가지며, 수중의 pH 증가에 따라 상대적으로 생성농도가 높은 것으로 보고되고 있다[10].
원수의 pH가 저하되면 THMs 생성능이 감소하는 이유로는 첫째, 수중에 용해되어 있는 소수성 부식질의 용해도 감소로 용존 농도가 감소하기 때문이다[10,11]. 둘째로는 염소의 반응성과 종 분화에 관련된 것으로 pH가 상승하면 HOCl의 산화력이 낮아져 CHCl3의 생성능 증가로 THMs 농도가 증가하고, pH가 저하되면 가수분해 반응이 억제되어 THMs 생성량이 감소된다[12,13].
Table 2에는 Fig. 3에서와 같이 동일한 수질조건에서 초기 pH 조건만 변화시킨 각각의 원수시료들에 염소 4 mg/L를 주입하여 염소 투입 전・후의 pH 변화를 나타내었다. 초기 pH가 9.5인 원수의 경우 염소 투입 후 pH가 8.9로 나타나 pH가 0.6 정도 저하되었으며, pH를 9.0으로 조절한 원수의 경우는 염소 4 mg/L 주입 후에 pH가 7.7로 낮아져 pH가 1.3 정도 저하되었다. THMs 생성량은 원수 성상 및 염소 주입량이 동일할 경우에는 염소 주입 후의 pH에 의해 결정된다[1]. 원수 pH를 9.5에서 9.0으로 낮춘 경우, 염소 주입 후 pH 저하가 1.3 정도로 가장 높게 나타나 초기 pH 9.5인 원수에 비해 THMs 생성농도 저감율이 18.3%로 가장 높게 나타났다. pH를 8.0으로 조절한 원수에서는 염소 주입 후 pH가 0.8 정도 낮아졌고, THMs 생성농도 저감율은 14.0%, pH를 7.0으로 조절한 원수의 경우는 pH와 THMs 생성농도가 각각 0.4 및 9.5% 저감되었다. 동일한 양의 염소를 주입하였을 때 초기 pH 조건에 따라 염소 주입 후의 pH 저감율에 차이가 발생하는 것은 수중에 존재하는 탄산염의 완충작용에 기인한 것이며[14], 동일한 양의 염소를 주입하여도 초기 pH에 따라 THMs 생성량에 차이가 발생하는 것을 알 수 있다. Fig. 3에서 볼 수 있듯이 원수 pH 7과 8의 THMs 생성농도에는 큰 차이를 보이지 않아 낙동강 하류원수의 pH가 상승하는 시기에는 황산이나 CO2를 이용한 pH 조절이 THMs 저감에 효과적이나 pH가 낮은 경우(pH 7~8)는 효과가 상대적으로 작은 것으로 나타났다.
3.2. 오존 처리가 THMs 생성에 미치는 영향
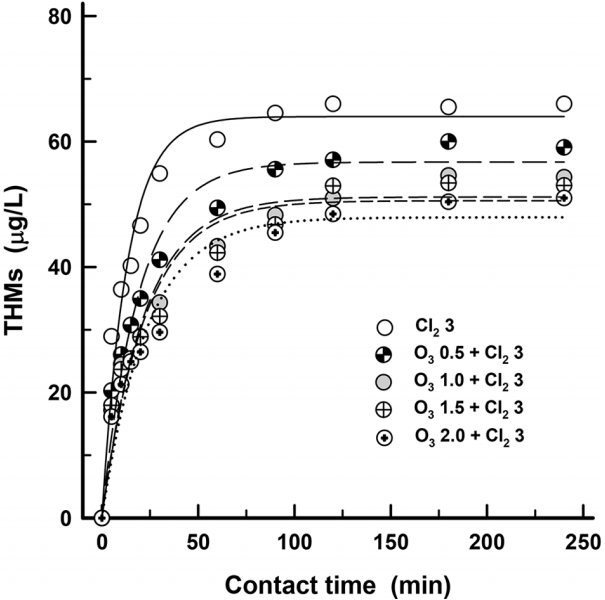
오존 처리가 THMs 생성에 미치는 영향을 알아보기 위해 원수에 오존을 0, 0.5, 1.0, 1.5, 2.0 mg/L 주입한 후 염소를 3 mg/L 주입하여 반응시간별 THMs 생성농도의 변화를 Fig. 4에 나타내었다.
오존을 각각 0.5 mg/L (0.12 mg・O3/DOC)와 1.0 mg/L (0.24 mg・O3/DOC)의 농도로 처리한 경우는 오존처리를 하지 않은 경우에 비해 THMs 생성농도가 각각 6%와 19% 정도 저감되었다. 또한, 오존을 각각 1.5 mg/L (0.36 mg・O3/DOC)와 2.0 mg/L (0.48 mg・O3/DOC)의 농도로 처리한 경우는 오존 처리를 하지 않은 경우에 비해 THMs 생성농도가 각각 20%와 24% 정도 저감되어 오존 투입농도가 증가할수록 THMs 생성농도의 저감율의 상승폭은 점점 감소하는 추세를 나타내었다.
일반적으로 오존처리는 수중 용존성 유기물질의 방향족고리나 탄소 이중결합의 파괴를 유발[15,16]하여 THMs 생성농도가 감소한다[17]. 낙동강 원수를 오존처리시 THM 생성능의 변화를 평가한 Son 등의 연구결과[18]에서는 오존 투입농도가 0.5 mg・O3/DOC에서 3 mg・O3/DOC로 증가할수록 THM 생성능 제거율은 17%에서 52%로 증가하였다고 보고하고 있어 THMs 제어에 오존처리의 중요성을 강조하고 있는 반면 Wang 등의 연구결과[19]에서는 0.2 mg・O3/DOC의 농도로 오존처리한 후 염소처리하였을 경우, 염소만 처리한 경우에 비해 THMs 생성농도가 7% 정도 감소하였으나 0.6~1.0 MG・O3/DOC의 고농도로 오존처리시에는 오히려 8%~23% 정도 THMs 생성농도가 증가하여 고농도의 오존처리가 THMs 생성농도의 증가를 유발할 수 있는 것으로 보고하고 있으며, 오존 처리에 의해 methyl-ketone 유사구조들로 변형 가능한 NOM을 많이 함유한 원수들은 오존 투입농도가 증가될수록 THM 생성농도가 증가될 수 있다고 보고하고 있다[19].
LC-OCD를 이용하여 오존 주입농도에 따른 DOC 농도 및 유기물질 특성변화를 Table 3에 나타내었다. 오존 주입량이 증가함에 따라 처리수의 SUVA값과 UV254의 경우 오존 투입농도 1 mg/L (0.24 mg・O3/L)에서 각각 20% 및 20% 감소하였으며, 오존 투입농도 2 mg/L (0.48 mg・O3/L)에서는 각각 28% 및 29% 감소하였다. DOC 농도는 거의 변화가 없었고, DOC 구성종의 변화를 보면 biopolymer (BP)의 농도는 오존 투입농도가 증가할수록 증가하는 경향을 나타내었고, BP의 경우는 조류를 구성하는 AOM (algogenic organic matter)으로 오존처리시 조체 파괴로 인해 수중으로 AOM이 용출되어 유발된 것으로 판단된다[9]. Humic substance(HS)는 DOC 농도의 50% 정도를 구성하는 물질로 오존처리에 의해 농도변화는 없었으나 평균분자량은 감소하여 저분자화되는 경향을 나타내었다. 따라서 오존 튜입농도 증가에 따른 HS의 저분자화가 UV254의 감소에 영향을 미친것으로 생각된다. 또한, building block (BB)의 경우는 오존 투입농도가 증가할수록 소폭 감소하였으며, BB는 HS에 비해 저분자 물질로 HS와 함께 염소와 반응성이 높아 DBPs생성에 큰 기여를 하는 것으로 알려져 있다[9].
SUVA값이 2 이상인 원수는 수중에 소수성 물질의 함량이 높은 원수로 염소와의 비교적 큰 반응성으로 인해 DBPs생성에 유리하다. 본 실험에 사용된 원수의 경우 SUVA값이 2.8 L/mg・m 정도로 상대적으로 높아 오존처리에 의해 SUVA의 저감율이 높았으며, 이전의 연구결과들에서도 오존처리에 의해 SUVA의 저감율이 높을수록 DBPs 생성 억제에 효과적이라고 보고하고 있다[20~22]. 또한, 2 이상의 높은 SUVA값을 나타내는 원수에서는 오존처리가 DBPs 저감에 효과적이나 2 이하의 비교적 낮은 SUVA값을 가지는 원수에서는 DBPs 저감에 미치는 오존의 영향은 낮은 것으로 보고되고 있다[22].
오존 투입농도 1 mg/L (0.24 mg・O3/L) 이상에서는 THMs 생성농도의 저감효과가 크게 증가하지 않아서 이후의 실험에서는 오존 투입농도를 1 mg/L로 고정하여 실험하였다.
3.3. 응집이 THMs 생성에 미치는 영향
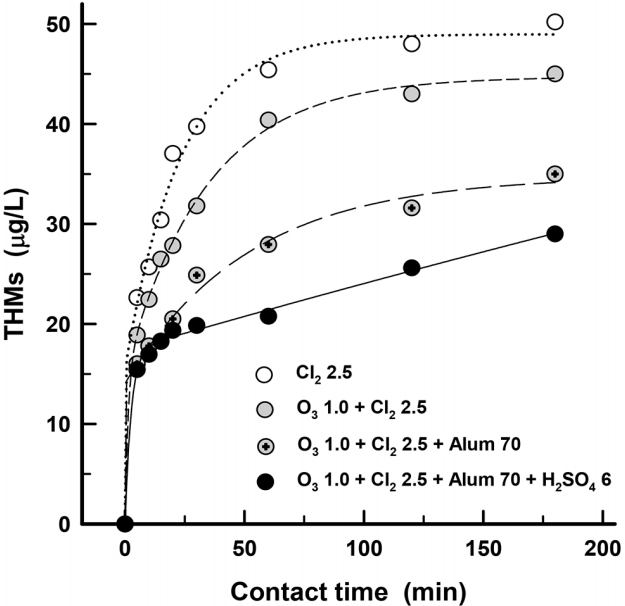
원수의 pH가 9 이상의 조건에서 응집이 THMs 생성에 미치는 영향을 다양하게 평가하기 위하여 전오존 + 전염소, 전오존 + 전염소 + 응집, 전오존 + 전염소 + 응집 + 황산투입을한 경우와 전염소만 처리한 경우를 염소투입 후 접촉시간별로 THMs 농도의 변화를 Fig. 5에 나타내었다.
오존 1 mg/L 주입한 후 염소 2.5 mg/L를 투입한 경우는 염소만 2.5 mg/L 투입한 경우에 비해 THMs 생성농도가 8%정도 감소되었고, 추가적으로 응집제인 alum을 70 mg/L 투입한 경우는 THMs 생성농도가 31% 정도 저감되었다. 또한, 응집시 alum 70 mg/L와 황산 6 mg/L를 투입한 경우는 THMs 농도의 저감율이 42% 정도로 나타나 원수 pH가 9 이상의 조건에서는 응집공정에서 황산을 함께 투입하여 pH를 저하시킬 경우 THMs 생성을 더욱 저감할 수 있는 것으로 나타났다.
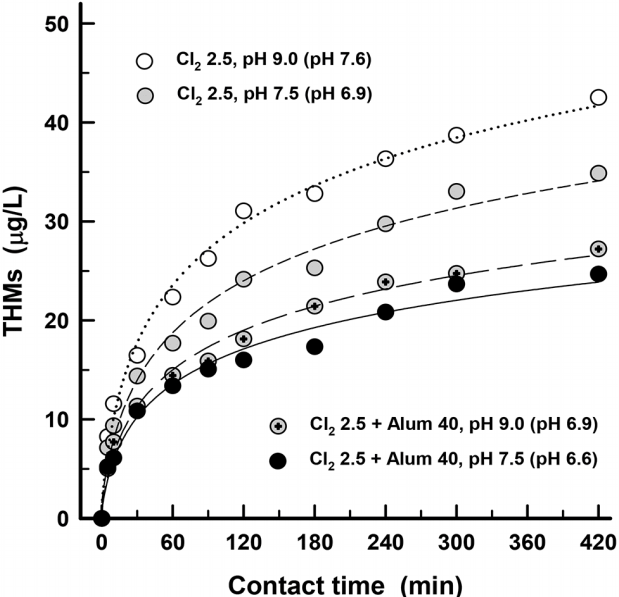
응집제 투입으로 인해 나타나는 THMs 생성농도 저감효과인 pH 저하와 유기물질 제거로 인한 영향을 구분해서 평가한 결과를 Fig. 6에 나타내었다. 응집제 투입으로 인한 pH 저하로 유발되는 THMs 생성농도 저감효과를 평가하기 위해 pH 9인 전오존 처리수와 응집제(alum)를 투입했을 경우와 동일한 pH가 되도록 황산을 이용하여 pH를 7.5로 조정한 후 염소 2.5 mg/L를 주입한 경우, 염소 2.5 mg/L를 주입하고 alum 40 mg/L를 주입한 경우에 대해 THMs 생성농도를 염소 접촉시간별로 조사하였다. 그 결과 초기 pH가 9.0인 경우에는 pH가 7.6으로 감소하였고, pH를 7.5로 조정한 경우와 alum 40 mg/L를 투입한 경우는 동일하게 pH가 6.9로 감소하였다.
pH를 7.5로 낮춘 후 염소를 투입한 결과, 초기 pH가 9.0인 전오존 처리수에 비해 THMs 생성농도가 19% 정도 저감되었고, 염소와 응집제를 주입한 경우는 THMs 생성농도가 대략 37% 정도 저감되었다. 염소와 응집제를 투입한 경우가 단순히 pH만 저하시킨 경우보다 THMs 생성농도 저감율이 높은 이유는 응집제에 의한 pH 저하와 수중의 유기물질 농도 감소가 동시에 유발되었기 때문이다. THMs 저감율은 응집제 주입시 pH 저하에 의한 효과 보다 응집시 유기물질 제거에 의해 18% 정도 더 높은 THMs 저감율을 나타내었다. 따라서 단순히 pH를 낮춰서 THMs 생성을 억제시키는 것보다 응집제를 주입하면 pH 감소와 유기물 제거가 동시에 유발되어 THMs 생성 억제에 효과적이었다.
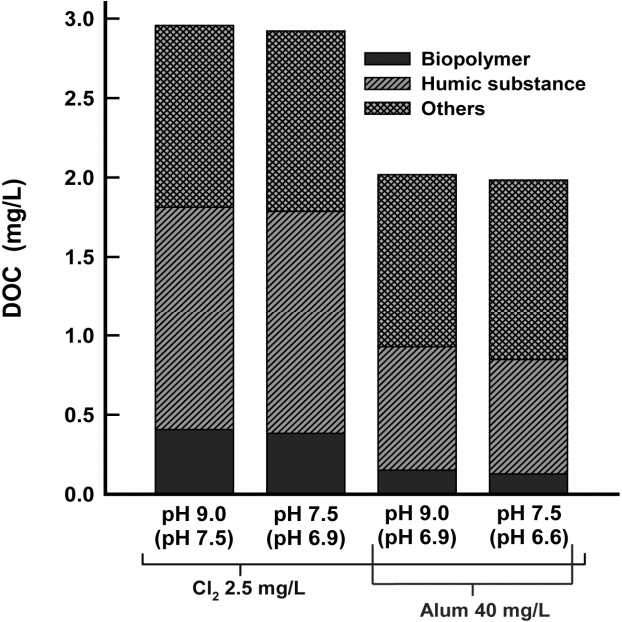
Fig. 6의 실험에 대한 응집 전・후의 유기물 성상 변화를 평가하기 위하여 LC-OCD로 분석한 결과를 Fig. 7에 나타내었다. pH가 9.0인 전오존 처리수의 경우, 응집 후에는 수중의 humic substance (HS)와 biopolymer (bp)의 농도가 응집제 투입 전에 비하여 각각 45% 및 63% 정도 감소하였다. 또한, pH를 7.5로 조정한 후 응집제를 투입한 경우는 pH 9.0인 전오존 처리수에 응집제만 투입한 경우에 비해 HS의 저감율이 4% 정도 더 상승하였다. HS는 상수원수 중에 비교적 높은 비율로 존재하며, THMs와 같은 DBPs의 대표적인 전구물질로 알려져 있다[9].
4. 결 론
낙동강 하류원수를 정수처리하는 정수장에서 THMs 생성농도를 줄이기 위해 취수장에서 pH만 낮춘 후 염소를 투입하는 경우와 전오존 처리 후 응집제 투입 전에 염소를 투입하는 경우를 모의하여 THMs 생성특성을 비교・평가한 결과 다음과 같은 결론을 얻을 수 있었다.
1) 하절기 조류번성기의 높은 수온(30℃)과 pH 조건(9.5)에서 THMs 생성영향을 평가한 결과, pH와 수온이 THMs 생성에 미치는 영향을 매우 크게 나타났다.
2) 황산을 이용하여 원수의 pH만 저하시킨 경우, pH가 높을수록 황산투입시 pH 저하에 따른 THMs 생성농도 저감율이 높게 나타났으나 pH가 낮을수록 저감율의 감소폭이 상대적으로 작았다.
3) 오존이 THMs 생성에 미치는 영향을 평가한 결과, 오존 투입농도 증가에 비례하여 생성되는 THMs 농도는 감소하였으나 오존 투입농도 0.36 mg・O3/DOC 이상에서는 추가적인 THMs 생성농도의 감소폭은 상대적으로 줄어들었다.
4) 응집이 THMs 생성에 미치는 영향을 평가한 결과, 응집제를 투입한 경우 황산으로 pH만 저하시킨 경우에 비해 pH 저하 및 유기물질 제거가 동시에 유발되어 THMs 생성농도는 매우 큰 폭으로 감소되었다.
5) 응집 전・후의 유기물 성상 변화를 평가한 결과, 수중의 humic substance 성분과 biopolymer 성분이 큰 폭으로 감소하여 THMs의 생성농도가 감소하였다.