The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
접촉 작동식 기기(승강기 버튼, 현금인출기, 스마트폰) 표면에 존재하는 미생물의 분리, 계수 및 동정
Abstract
Objectives
The purpose of this study was to identify and isolate bacteria on the surface of elevator buttons, ATM screens, and smartphone surfaces. Through this process, bacterial diversity and presence of pathogens on the surface were evaluated for the prospective public health and environment.
Methods
Bacterial samples collected from elevator buttons, ATM screen surfaces, and smartphone surfaces were analyzed their CFUs using LB agar plates. Unique colonies in the plates were isolated and identified by the 16S rRNA analysis. The diversity of the bacteria in the collected samples containing high number of CFU was monitored using the Denaturing Gradient Gel Electrophoresis (DGGE).
Results and Discussion
Among the instrument surfaces, the elevator buttons showed the highest CFU (average: 163±17 CFU/cm2). The samples from smartphone and ATM surfaces have 66±13 and 6±1 CFU, respectively. The CFU analysis also showed that the all collected samples had active bacterial species, and the 16S rRNA analysis indicated that pathogenic bacteria were existed on the surface on the buttons and screens. The DGGE analysis showed that higher diversity of bacterial species were found compare to the CFU analysis of the samples. This difference in the bacterial diversity is probably due to the difference in optimal cultivation conditions of each bacterial species in the samples.
Conclusions
The user interfaces of the elevators, ATMs, and smartphones contained high diversity of normal and pathogenic bacterial species. Thus attention must be paid to the transfer of pathogenic bacteria in children, pregnant women, immunocompromised patients.
Key words: Elevator button, Smartphone surface, ATM screen, Colony forming unit, DGGE
요약
목적
본 연구에서는 다수의 사람이 손끝으로 작동시키는 각종 접촉 작동식 기기의 접촉부에 존재하는 세균을 계수 및 분리하였으며 이들 중 배양이 가능한 세균을 16S rRNA 분석을 통하여 동정하였다. 이 과정을 통하여 각종 기기의 표면에 존재하는 세균의 수와 종류를 확인하고 존재하는 세균의 다양성과 위험성을 확인하고자 하였다.
방법
공공건물(10층 기준)의 승강기 버튼과 시중 은행의 현금인출기 표면 및 스마트폰 표면에서 시료를 채취하여 분석하였다. 세균의 수는 시료를 다단 희석한 후 LB agar에 도말하여 CFU (Colony Forming Unit)를 확인하였으며, 분리된 세균의 동정은 16S rRNA분석을 통하여 진행하였다. 또한 많은 CFU가 확인된 시료는 별도의 DGGE (Denaturing Gradient Gel Electrophoresis) 분석을 실시하여 다양한 세균종의 분포를 확인하였다.
결과 및 토의
채취된 시료의 분석 결과, 승강기 버튼에서 가장 높은 CFU가 확인되었다(평균 163±17 CFU/cm2). 또한 스마트폰 화면과 현금인출기 화면에서는 1 cm2 당, 각각 평균 66±13 CFU 및 6±1 CFU가 검출되었다. 전체 시료 중 세균이 검출되지 않은 시료는 없었으며, 세 종류의 기기에서 모두 병원성 미생물이 발견되었다. 또한 DGGE 분석결과, 모든 기기의 시료에서 LB배지에서의 배양보다 많은 수의 미생물종이 확인되었다. 특히 현금인출기의 표면에서 측정된 CFU와 DGGE의 결과에서 많은 차이가 발생하였다. 이는 각각의 환경에 존재하는 세균종의 배양에 필요한 최적 환경이 다름에 기인한 것으로 보인다.
결론
본 연구의 결과, 사람의 접촉이 잦은 기기의 표면에는 다양한 종류의 병원성 미생물이 존재함을 확인했으며, 이는 병원성 세균의 전달에 의한 감염에 사용자들이 노출될 수 있음을 보여준다. 따라서 면역력이 떨어지는 어린이, 임산부, 환자 및 노인의 경우, 각종 접촉 작동식 기기의 사용 전・후에는 충분한 위생에 대한 주의가 필요하다고 판단된다.
주제어: 승강기 버튼, 스마트폰 표면, 현금인출기 화면, 세균수, DGGE
1. 서 론
2018년 행정안전부에서 발표한 승강기 보유 현황에 의하면, 국내 전체 승강기 보유 대수는 2018년을 기준으로 683,641대인 것으로 확인되며, 건축물의 고층화 및 대형화와 이용자의 편의를 위해 승강기의 수는 계속 증가하고 있다[ 1]. 또한, 2018년 한국은행 소속의 금융결제국에서 발행한 2017년 지급수단 이용행태 조사결과에 의하면, ATM (Automated Teller Machine, 현금인출기)을 이용한 월평균 현금 인출횟수는 3.0회이고 현금 인출 시 현금인출기를 이용한다고 응답한 비율이 90.2%로 금융기관 창구(33.7%) 등 여타 방식에 비해 높게 나타났다[ 2]. 스마트폰의 경우 거의 모든 작동이 손끝을 이용한 터치스크린 등을 통하여 이루어지고 있다. 2017년 인터넷 이용실태조사 요약보고서에 따르면 만 3세 이상 스마트폰 이용자의 이용시간은 주당 평균 10시간 17분인 것으로 나타났으며, 일주일에 14시간 이상 이용하는 비율도 31.3%나 차지하는 것으로 나타났다[ 3]. 또한 2017년 통계청에서 발표한 ‘한국의 사회지표’에 따르면 우리나라의 스마트폰 가입률은 90.6%인 것으로 집계될 정도로 대부분의 국민들이 스마트폰 가입자임을 짐작할 수 있다[ 4]. 따라서 일반적인 현대 사회 구성원은 다양한 손끝 접촉식 기기를 거의 필수적으로 사용하게 되며, 이를 통한 다양한 종류의 미생물들이 서로 다른 기기의 버튼, 터치스크린 등의 표면에 교대로 전달되기 때문에 이들이 새로운 병원성 미생물의 오염원이 될 가능성이 높다고 판단된다. 최근 한 연구에서는 대학교의 학생들에게 전파된 특정 병원성 미생물에 대한 노출경로와 노출량을 보여주고 있으며, 급식소, 승강기 및 여러 학습시설을 통한 교차 감염이 가능하다는 것을 나타내고 있다[ 5]. 따라서 더욱 다양한 활동영역을 갖는 여러 사회구성원이 매일 사용하는 승강기 및 현금인출기, 그리고 이런 기기를 작동하기 전후에 교차 사용되는 스마트폰 표면은 다양한 미생물에 의한 오염이 이루어질 수 있으며, 각종 접촉식 작동 기기 사용 후 손 세척 등 개인위생에 주의를 기울이지 않는다면, 식품제조, 음식준비, 식사, 화장, 유아의 놀이 등 다양한 활동을 통하여, 인체에 병원성 미생물을 전달할 수 있게 된다. 따라서 본 연구에서는 일반적인 사회 구성원이 공공으로 사용하는 각종 접촉 작동식 기기(승강기 버튼, 현금인출기, 스마트폰)의 표면 중 손끝으로 작동이 이루어지는 부분에서 시료를 채취하여 이를 일반 세균 증식용 배지에 배양을 진행하였다. 이 결과를 바탕으로 기기의 표면적당 배양 가능한 세균수 측정 및 세균군의 동정을 실시하였고, 기타 배양이 불가능한 세균의 분포는 DGGE (Denaturing Gradient Gel Electrophoresis)를 사용하여 분석하여 보였다.
2. 재료 및 방법
2.1. 시약
본 연구에서는 phosphate buffer saline (PBS) tablet (Sigma, USA), Luria-Bertani (LB) broth (Becton, Dickinson and Company, USA) 등을 사용하여 시료의 채취 및 배양을 진행하였으며, DNA extraction kit (Da BeadTM Genomic DNA Prep Kit, Biofact, Korea), gel extraction kit (QIAquick® Gel Extraction Kit (50), Quagen, Germany)등의 시약을 사용하여 접촉식 기기의 표면 미생물의 분자생물학적 분석을 진행하였다.
2.2. 시료의 채취
세균의 CFU 측정 및 동정을 위한 시료는 서울 광진구에 위치한 10개의 건물 내 10대의 승강기 버튼, 32대의 현금인출기, 그리고 학생 및 교직원이 사용하고 있는 41개의 스마트폰을 대상으로 하여 2018년 8월부터 2019년 4월까지 일주일에 한 번씩 동일한 시간(오후 3시)에 시료를 채취하였다. 모든 실험은 시료 채취용 해당 1 기기 당 3곳의 다른 위치에서 채취하여 실험을 진행하여 표면적당 CFU 평균값을 계산하였다. 시료 채취에 사용된 사각 틀은 필터 페이퍼(Whatman ® Filter Papers No.2, UK (England))를 2×2 cm의 정사각형 모양으로 잘라낸 후, 중앙을 1×1 cm의 정사각형 형태로 오려내어 증기 멸균한 후 사용되었다. 사각 틀을 이용한 시료 채취에 있어서는 각각의 기기에서 시료를 채취하고자 하는 기기 표면에 사각 틀을 위치시키고 틀 내부의 1×1 cm가 되는 표면 전체를 증기 멸균한 면봉으로 10회 문질러 채취하였다( Fig. 1). 채취 후 면봉과 손이 접촉된 부분을 제거한 후, PBS 1 mL (pH 7.0±0.2)가 담긴 1.5 mL eppendorf tube에 넣어 실험실로 운반하였다. 모든 분석은 1시간 이내에 채취된 시료를 사용하였으며, 분석하기 전, voltex mixer를 사용하여 강하게 혼합하였다[ 6, 7].
2.3. 미생물의 분리 및 배양
채취한 시료의 세균 CFU 측정을 위한 실험에서는 LB agar (Luria-Bertani broth 2.5%, agar 1.5%, pH 7.0±0.2)를 사용하였으며, 채취한 시료 20 µL를 도말한 후, 37℃에서 48시간 동안 배양하였다[ 8]. 배양 후에 생겨난 독립적인 집락을 계수하여 표면적당 CFU/cm 2를 결정하였다. 시료를 도말한 배지를 48시간 배양한 후에 색상, 형태 등을 육안으로 구분하여 단일콜로니를 분리하였고, 분리된 미생물은 새로운 LB agar에 획선 도말한 후 37℃에서 48시간 동안 배양하였다. 이때 생성된 콜로니를 확인하여 단일콜로니를 재분리 후, 이를 사용하여 미생물 동정을 진행하였다. 각각의 분리된 콜로니의 16S rRNA sequencing은 대전 소재 Biofact Co.(Korea) 에 의뢰하여 분석하였다. 승강기 버튼, 현금인출기, 스마트폰 시료 중 콜로니가 가장 많이 생성된 각 2종의 시료를 사용하여 DGGE 분석을 실시하였다.
2.4. DGGE 분석
위에서 선택한 시료의 DNA는 상기 extraction kit를 사용하여 추출하였으며, 16S rRNA gene은 다음과 같은 primer를 이용해 1차 PCR (polymerase chain reaction)을 진행하여 증폭하였다: E27F(5'-AGAGTTTGATCCTGGCTCAG-3'), 1542R(5'-GGTTACCTTGTTACGACTT-3') [ 9]. 1차 PCR은 Thermal cycler (Hush Run TM, TC-96/G/H(b)C, Biofact, Korea)를 사용하여 94℃에서 20초(denaturation), 62℃에서 40초(annealing), 72℃에서 1분 30초(polymerization)간 30 cycle을 반복하여 반응시키는 조건으로 수행하였다. 이후 1500bp size의 밴드를 gel extraction kit를 사용하여 밴드 내 DNA를 추출하였으며, 추출된 DNA를 다음과 같은 primer를 이용해 2차 PCR을 진행하여 증폭하였다: E341F-GC(5'-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG-3') [ 10], 785R(5'-CTACCAGGGTATCTAATC-3') [ 11]. 2차 PCR은 1차 PCR과 동일한 기기를 사용하여 진행하였으며 95℃에서 20초(denaturation), 65℃-55℃ (-0.5℃/cycle)간 40초(annealing), 72℃에서 1분(polymerization)간 20cycle을 반복한 후, 95℃에서 20초(denaturation), 55℃에서 40초(annealing), 72℃에서 1분(polymerization)간 15cycle을 반복하여 반응시켰다. 2차 PCR이 완료된 후에는 10% (w/v) 폴리아크릴아마이드(37.5:1 acrylamide:bisacrylamide)를 포함하는 DGGE 겔을 사용하여 DGGE를 진행하였다. 겔 제작 시 유레아(Urea, Sigma, USA)와 포름아마이드(Formamide, ReagentPlus ®, ≥99.0% (GC), Sigma, USA)로 Variable flow mini-pump (MPP-100-220, C.B.S. Scientific Company, Inc.)를 이용하여 40-70% 농도구배를 주었고 50×TAE (Tris/acetic acid/EDTA, Bio-Rad, USA)를 1차 증류수로 50배 희석하여 사용하였다. 110 volt에서 20시간동안 겔을 이동시켰으며 이 때 사용한 겔의 조성표는 Table 1에 표기하였다. 20시간 후, 1차 증류수 1 L에 브로민화 에티듐(EtBr, Sigma, USA) 120 µL을 희석시킨 용액에 15분간 staining 후, 1차 증류수에서 7분간 destaining하여 UV transilluminator (MUV26-312, Major science, USA)를 이용해 밴드를 관찰하였다.
3. 결과 및 고찰
3.1. 접촉 작동식 기기의 표면에 존재하는 세균수(CFU) 측정
총 140개의 승강기버튼 표면을 2018년 8월부터 2019년 4월까지 각 버튼 당 3회 씩 증기 멸균한 면봉을 사용하여 세균 시료를 채취하고 이 시료의 배양 가능한 세균의 CFU를 측정한 결과, 승강기 버튼에서는 1 cm 2 당 163±17 CFU의 세균이 검출되었다. 같은 기간에 같은 방법으로 32대 현금인출기의 화면 표면 1 cm 2에 존재하는 세균수는 평균 6±1 CFU였다. 또한 41개의 스마트폰 화면에서는 평균 66±13 CFU가 검출되었다( Fig. 2). 승강기 버튼, 현금인출기, 및 스마트폰 등 본 실험에서 시료를 채취하는데 사용된 모든 기기에서 세균이 검출되었으며, 시료를 채취한 기기 중 승강기 버튼에서 표면적당 CFU 값이 가장 높게 나타났다. 그러나 승강기 표면의 세균 수는 8-9월(CFU: 169±26), 1-2월(CFU: 168±37), 3-4월(CFU: 152±34)에 걸쳐 큰 변화가 관찰되지 않았다( Fig. 2). 현금인출기의 경우는 승강기 버튼과 달리 상대적으로 낮은 수의 CFU가 검출되었으며, 8-9월보다는 1-2월과 3-4월에 상대적으로 낮은 수의 CFU가 검출되었다. 스마트폰 표면의 경우 8-9월에 가장 높은 수의 CFU가 검출되었으며, 이는 계절적 요인으로 인하여 상대적으로 많이 발생한 사용자의 땀이 스마트폰 표면에 묻어 습한 환경을 제공함으로써 세균수를 높게 유지시키는 것으로 보인다[ 12]. 본 실험 결과에서 승강기 버튼의 표면보다 스마트폰의 표면에서 낮은 수의 CFU가 확인된 이유는 개인이 사용하는 스마트폰의 경우 수시로 표면을 세척하는 경우가 많기 때문인 것으로 판단되며, 승강기 버튼의 경우 거의 세척 또는 청소가 이루어지지 않기 때문인 것으로 보인다. 또한 한 연구에서는 표면이 거칠수록 표면적이 증가하게 되고 액체와 표면간의 친화성(affinity)이 증가한다고 보고하고 있는데, 습한 환경은 상기와 같이 세균수를 높게 유지시킬 수 있는 원인이 될 수 있기 때문에 승강기 버튼의 표면은 다른 접촉 작동식 기기들과 달리 층수가 새겨진 각인이나 점자 표시와 같이 굴곡진 부분이 있다는 점, 그리고 승강기 버튼의 표면 소재가 금속이기 때문에 현금인출기의 화면이나 스마트폰의 스크린부분보다 비교적 거친 재질이라는 점을 고려하여 CFU가 다른 접촉 작동식 기기보다 높은 수치를 기록한 것으로 기록될 가능성도 있을 것으로 판단된다[ 12, 13]. 채집한 승강기 버튼 시료를 층별로 분석한 결과, 지하 1층 버튼과 열림, 그리고 1층 버튼에서 평균대비 높은 CFU가 측정되었다( Fig. 3). 이와 같은 CFU의 차이는 각 버튼의 사용 빈도에 영향이 있는 것으로 보인다.
3.2. 기기 표면에서 발견되는 미생물의 종류 확인
3.2.1. 승강기 버튼에서 발견되는 미생물
총 140개의 승강기 버튼에서 콜로니의 형태 및 색깔 차이 등 시각적 관찰 기준으로 서로 다른 단일종으로 보이는 균을 분리하고 이들을 재배양 후, 16S rRNA 방법을 통하여 동정한 결과, 총 14종의 세균을 분리할 수 있었다. 또한 분리 동정 결과를 검토하였을 때, 모든 승강기 시료에서 Micrococcus yunnanensis가 공통적으로 검출되었다. Micrococcus sp.는 피부 표면에 상재하는 미생물 속으로 잘 알려져 있다[ 14]. M. yunnanensis 외에 뇌 농양을 일으킬 수 있는 미생물인 Brevibacterium casei [ 15]를 비롯하여 인간에게 감염 위험이 있는 Staphylococcus haemolyticus [ 16], S. hominis [ 17], S. epidermidis [ 18], S. hominis [ 19] 등이 함께 검출되었다. 이들은 모두 인간의 피부에 대한 감염성 질환을 일으킬 수 있다고 알려져 있다. 또한 분리된 세균 중 하나인 Rhodococcus corynebacterioides은 패혈증을 일으킬 수 있는 병원성 균으로 분류된다[ 20]. 피부 상재균으로 잘 알려져 있는 S. epidermidis와 S. hominis는 승강기 버튼과 스마트폰 시료에서도 공통적으로 동정되었으며, 승강기 버튼에서만 동정된 특이적인 균으로는 Brachybacterium paraconglomeratum, M. yunnanensis, Moraxella osloensis, R. corynebacterioides, Streptomyces drozdowiczii가 있다. 특히 M. osloensis에 의한 감염은 심내막염, 뇌수막염, 골수염, 화농성 관절염, 질염, 균혈증 등을 초래할 수 있다고 알려져 있다[ 21]. 그 외에는 식물의 뿌리( M. yunnanensis, B. paraconglomeratum) 및 토양( S. drozdowiczii)에서 흔히 발견되는 균들로, 여러 가지 다른 환경에서 근무하는 사람들이 공통적으로 접촉하는 기기인 만큼 다양한 환경에서 발견되는 균들이 함께 분리 및 동정되었다[ 22~ 24]. 이상의 결과는 Table 2와 Fig. 4에 정리하여 표기하였다.
3.2.2. 현금인출기 화면에서 발견되는 미생물
승강기에서 사용한 것과 같은 방법으로 총 32대의 현금인출기 화면에서 시료를 취하여 분리 및 배양한 후, 16S rRNA 방법을 통해 동정한 결과, 8종의 세균을 확인하였으며, 그들 중 5종이 병원성 미생물로 확인되었다. 검출된 균의 종류 중 Microbacterium paraoxydans는 감염 시 균혈증이 유발될 수 있다는 사례가 2018년 보고된바 있는 세균이다[ 25]. 그 외에도 Micrococcus luteus는 피부 감염을 일으킬 수 있고 특히, 면역력이 낮은 사람들에게는 감염 시, 패혈성 쇼크를 일으킨다고 알려져있다[ 26]. M. luteus는 스마트폰 시료에서도 발견되어 주의를 요한다. 현금인출기의 경우, 전반적으로 낮은 CFU 검출수와 함께, 특이 세균군은 분리되지 않았다. 현금인출기의 표면은 관리 회사의 규정에 의하여 주기적으로 세척되기 때문에[ 27] 낮은 CFU가 검출된 것으로 판단된다. 현금인출기 시료의 분리 및 동정결과는 Table 3와 Fig. 5에 정리하여 표기하였다.
3.2.3. 스마트폰 화면에서 발견되는 미생물
승강기에서 사용한 것과 같은 방법으로 총 41대의 스마트폰 화면에서 시료를 채취하고, 세균을 분리 및 동정한 결과 15종류의 세균종을 확인할 수 있었다. 또한 이 세균종 중 10종류의 균이 병원성 세균으로 분류될 수 있었다. 스마트폰 시료에서는 면역력이 저하된 환자가 감염되었을 때, 패혈증을 유발시킬 수 있는 Staphylococcus hominis [ 28]와 화농성 염증 및 장염, 식중독 등을 유발할 수 있는 기회감염성 세균인 S. aureus [ 29], 균혈증을 유발시킬 수 있는 S. warneri [ 30], Roseomonas mucosa [ 31], 뼈와 관절에 감염을 일으킬 수 있는 S. caprae [ 32], 혈류 감염을 일으킬 수 있는 Dermacoccus barathri [ 33] 등이 분리 및 동정되었으며, 그 결과를 Table 4와 Fig. 6에 표기하였다. 각각의 시료 별로 확인하였을 때, 기기당 최대 12종류의 세균이 분리, 배양 및 동정되었다. 모든 스마트폰 시료에서 피부 상재균 S. epidermidis가 공통적으로 분리되었는데 이 균은 면역력이 약화됐을 때에 감염을 일으킬 수 있는 기회감염병원체(opportunistic pathogen)으로 알려져 있다[ 18]. 승강기 버튼, 현금인출기 및 스마트폰에서 발견된 세균종을 Fig. 7에 정리하여 표시하였다. 각 기기간 공통적으로 발견된 세균종은 각 다이어그램의 겹치는 부분에 삽입하였다. 승강기 버튼과 현금인출기 사이에는 공통적인 미생물 종이 분리되지 않은 반면, 스마트폰-승강기 버튼과 스마트폰-현금인출기 사이에서의 공통적인 균종이 검출되었다. Micrococcus luteus는 현금인출기와 스마트폰에서 공통적으로 분리된 세균이며 S. epidermidis와 S. hominis는 승강기 버튼과 스마트폰에서 공통적으로 분리된 세균으로 확인되고 있다. 스마트폰에서만 특이적으로 분리된 세균은 Cellulomonas pakistanensis, Fictibacillus phosphorivorans, Kocuria marina, K. palustris, K. rhizophila, Roseomonas mucosa가 분리 및 동정되었다. 승강기 버튼, 현금인출기 및 스마트폰에서 분리된 세균의 균종이 서로 다른 이유는 사용 빈도, 세정/세척 과정의 유무, 그리고 스마트폰은 개인별 사용에 의존점이 높지만 나머지 두 가지 기기는 공동적으로 사용되는 기기이기 때문에 개인별 위생상태나 노출되어지는 환경에 따라 미생물의 차이가 발생되어 스마트폰에서 특이적인 미생물들이 검출된 것으로 생각된다. 이러한 일반적 원인과 함께, 시료를 채취한 승강기 사용 건물 특성(예: 지하 식당, 쓰레기 처리장 등)과 현금인출기의 위치, 스마트폰 사용자의 접촉 피부 상태 등 주변의 환경적 요인이 작용한 것으로 보인다.
3.3. DGGE 기법을 이용한 접촉 작동식 기기 표면의 세균 군집 분석
시료에서의 세균 분리, CFU 측정을 위하여 고체배지를 이용한 평판배양법이 일반적인 방법으로 사용되고 있으나, 세균의 종류에 따른 다양한 영양요구성, 배양조건 그리고 배양시간 등의 각종 생육조건을 모두 충족시킬 수 없기 때문에 시료 내의 모든 세균종의 분리 및 배양이 불가능하다는 문제점이 있다. DGGE 방법은 PCR을 통해 증폭된 DNA를 이용하여 균종의 다양성을 고체배지 배양 방법보다 더 정밀하게 확인할 수 있는 방법으로써, 일반적인 배지를 사용한 배양을 통해서는 확인될 수 없는 세균의 종류 확인이 가능한 방법이다. 그러나 시료상의 DGGE의 경우 시료의 우점종을 중심으로 분석되는 경우가 많기 때문에 시료상의 모든 세균종을 분석하는 방법은 아니다. 다만 본 실험에서는 고체배지 배양방법의 한계를 보완하기 위하여 DGGE를 진행하였다[ 34]. 승강기 버튼, 현금인출기 표면 및 스마트폰 표면 기기에서 채취한 시료를 평판 배지에서 증식시켰을 때, 각 기기 당 형태적으로 가장 다양한 종류의 콜로니가 검출된 2개의 시료를 채택하고 이를 DGGE 분석 시료로 사용하였다. 시료의 genomic DNA를 DNA extract kit를 이용하여 추출하고, 1차 PCR과 2차 PCR 과정을 통해 DNA를 증폭시켜 16S rDNA-PCR 산물의 DGGE를 수행하였다. 분석 결과, Fig. 8과 같은 DGGE fingerprint를 얻었다. 승강기 버튼, 현금인출기, 스마트폰 시료에서 가장 다양한 콜로니 형태를 갖는 시료 각 2종을 선정하여 DGGE를 시행하고 그 결과를 확인하였을 때, 평판 배양에서 발생하는 세균 콜로니 대비, 대단히 많은 수의 band가 나타났다. 또한 6종의 시료에서 공통적으로 같은 위치에 존재하는 것으로 추정되는 band가 다수 보이는 반면, 각 샘플마다 갖는 독자적인 band도 존재하였다. DGGE 상의 band가 다양하게 확인되는 것은 다양한 세균종 또는 동일 세균종 내의 다른 아종(substrain)이 존재하는 것을 나타낸다[ 34]. 현금인출기 화면의 시료는 하나의 고체배지에서 상대적으로 적은 종류의 세균(최대 6종)이 분리되었으나 DGGE 결과, 세 종류의 시료 중 가장 다양한 사이즈의 band (20개 이상)가 확인되어 고체배지 배양법에 의해 분리된 세균의 수와 DGGE를 통해 확인한 band의 개수의 차이가 세 종류의 접촉 작동식 기기 중 가장 큰 것으로 나타났다. 이는 본 실험에서 사용한 CFU 측정용 배지가 현금인출기 표면에 존재하는 다양한 세균류의 배양에 적당하지 않음을 나타내고 있으며, 일반적인 세균 배양용 배지를 사용한 특정 시료의 CFU 확인에 어려움이 있음을 나타내고 있다. 또한 주기적인 세척이 이루어진다고 하더라도 현금인출기 화면 모서리 부분은 청소 및 세척 작업이 제대로 이루어지지 않아 시료 채취 작업 당시 체모 및 먼지 등이 다수 발견되었다. 그러나 현금인출기 화면의 중앙 부분에서는 상기대로 주기적인 세척에 의해 매우 낮은 CFU가 검출되어 현금인출기 화면의 평균 CFU 또한 낮게 기록되었으나, 도말 및 배양 결과, 콜로니의 수가 가장 많았던 현금인출기 화면 모서리 부분에 해당하는 시료로 DGGE를 진행하였을 때, 매우 다양한 위치에서 band가 분리되었다. 승강기 버튼의 경우, 한 버튼 시료에서 분리된 세균은 최대 7종이였으나 DGGE에서는 17개 이상의 band가 분리되어 나타났다. 스마트폰에서는 한 시료에서 최대 8종의 세균이 분리되었으나 DGGE에서는 18개 이상의 band가 나타났다. 세 종류의 접촉 작동식 기기 모두 고체배지에서 분리된 세균의 종류보다 더 많은 종류의 band가 나타났으며 이는 고체배지에서 분리 및 동정되었던 미생물보다 더 다양한 종 및 아종의 세균이 기기의 표면에 존재함을 의미한다. 따라서 이들에 대한 분리 및 동정 등 추가적인 연구가 진행 된다면 공공 위생 증진 및 쾌적한 생활환경 조성에 중요한 지표를 제공할 것으로 판단된다.
4. 결 론
본 연구의 결과, 승강기 버튼과 현금인출기 화면, 그리고 스마트폰 표면에는 다양한 종류의 미생물이 존재하고 있음을 확인하였다.
표면적당 CFU의 경우, 승강기 버튼이 가장 높은 수치인 163±17 CFU/cm2로 측정됐으며, 스마트폰 화면에서는 66±13 CFU/cm2, 현금인출기의 화면에서는 가장 낮은 수치인 6±1 CFU/cm2가 측정되었다. 이는 승강기 버튼과 스마트폰과는 달리, 현금인출기는 ATM 관리 사업의 일환으로 주기적인 청소 및 세척과 같은 환경 관리가 이루어지고 있기 때문에 표면적당 CFU가 낮게 나온 것으로 추정된다. 반대로 승강기 버튼은 현금인출기처럼 다양한 사람들에게 노출되지만 주기적인 세척이 이루어지지 않기 때문에 CFU가 높게 측정됐다고 생각되어진다.
고체배지를 이용한 균 분리 및 동정 결과, 스마트폰에서 가장 다양한 균종(15종)이 분리 및 배양되었는데, 이는 사람이 휴대를 하면서 다양한 주변 환경과 사람에게 노출되기 때문인 것으로 예상되며 얼굴과 손에서의 체액이 표면에 전달되어 세균이 번식하기 좋은 환경을 제공하기 때문이라고 생각된다.
스마트폰에서는 승강기 버튼과 현금인출기 모두에서 공통적인 균이 검출되었는데, 이는 다른 접촉식 기기보다 지속적이고 반복적인 접촉이 이루어지기 때문에 더 많은 교차오염에 노출된 것으로 판단된다.
승강기 버튼에서는 14종, 현금인출기에서는 가장 적은 8종이 분리되었다. 그러나 DGGE 결과, 세 종류의 접촉 작동식 기기 중 현금인출기에서 가장 다양한 사이즈의 band가 확인되었다. 이는 현금인출기가 다양한 사용자에게 쉽게 노출될 수 있는 환경의 기기일 뿐만 아니라 현금인출기 화면의 모서리 부분과 같이 청소 및 세척 작업이 미흡한 부분에서 체모 및 먼지가 집중되어있었던 점과 사용된 고체 배지에서는 배양되지 않았던 미생물들에 의해 위와 같은 DGGE 결과로 나온 것이라 판단된다.
세 종류의 시료에서 공통적으로 발견된 미생물 속은 Bacillus sp.와 Staphylococcus sp.로 나타났다. 이 두 종류의 속에는 다수의 피부 상재균종이 속해있기 때문에 접촉 작동식 기기에 공통적으로 동정된 것으로 생각된다.
현금인출기와 스마트폰에서는 공통적으로 M. luteus가 발견되었고 승강기 버튼과 스마트폰에서는 공통적으로 S. epidermidis와 S. hominis가 발견되었는데 세 종의 미생물 모두 기회감염병원체로 분류되기 때문에 교차 오염을 통한 감염에 주의하여야 할 것으로 판단된다. 뿐만 아니라 미생물 동정 결과에서 세 종류의 시료 모두 인간에게 감염을 일으킬 수 있는 병원성 미생물이 검출되었으며, 그 중에서도 뇌 농양, 패혈증, 신생아 균혈증 등과 같은 병을 유발할 수 있는 미생물들도 검출되었기에 주의가 필요하다.
이와 같은 다중 이용 시설이나 스마트폰에서는 다양한 종류의 유해성 세균이 존재하고 있음을 확인됐으며, 사용자들 사이에 미생물 감염을 일으킬 수 있는 위험성이 매우 높다. 세 종류의 시료는 면역력이 낮은 아이와 노인까지 다양한 연령대의 사람들이 쉽게 접근할 수 있는 기기이기 때문에 상처가 있는 손끝으로 접촉하여서는 안되며, 접촉 작동식 기기의 사용 후에는 손을 씻거나 손소독제, 항균 물티슈 등을 이용하여 적절한 예방 조치를 취하는 것이 좋다. 또한 기기의 정기적인 제균 및 살균 활동은 교차 오염의 위험을 줄일 수 있을 뿐만 아니라 미생물의 생육을 크게 감소시킬 수 있기 때문에 이에 대한 지속적인 관리가 필요할 것으로 판단된다.
Acknowledgments
이 연구는 2018학년도 건국대학교의 연구년교원 지원과 농촌진흥청 연구사업(세부과제번호: PJ012550032019)의 지원에 의해 연구되었습니다. 이에 감사드립니다.
Fig. 1.
The schematic illustration of sampling tool (A) and sampling areas of the elevator button surface (B), smartphone screen (C) and ATM screen (D). 
Fig. 2.
Detection of bacterial CFU/cm2 from the samples obtained from 140 elevator buttons (A), 32 ATM screens (B), and 41 smartphone surfaces (C). 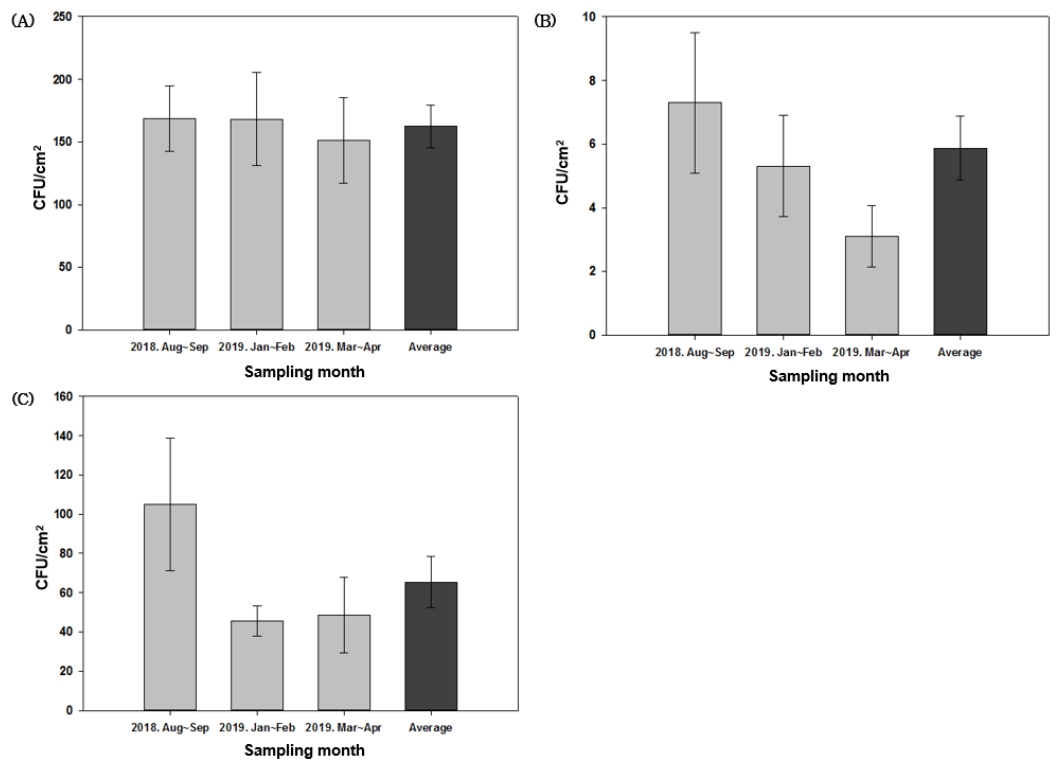
Fig. 3.
Bacterial CFU distribution in elevator buttons. The numbers in the x-axis of the graph indicate the level number buttons of elevator. For the CFU analysis, samples collected from 10 elevators were used. 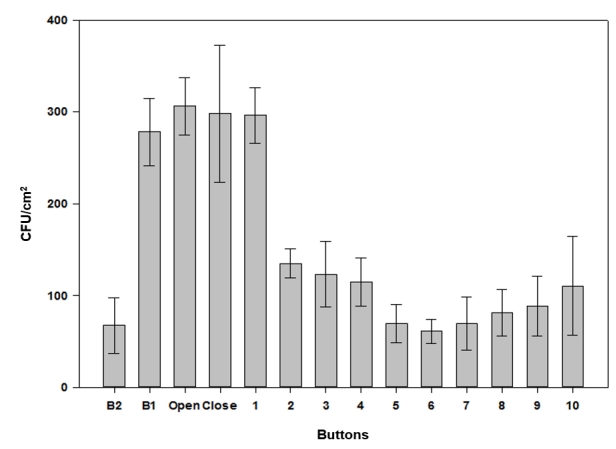
Fig. 4.
Examples of the isolated microorganisms from elevator buttons. 
Fig. 5.
Examples of the isolated microorganisms from ATM screens. 
Fig. 6.
Examples of the isolated microorganisms from smartphone surfaces. 
Fig. 7.
The mutual relationship of the isolated bacteria from the elevator bottons, ATM screens, and smartphone surfaces. The single diagram in the figure contains the name of the isolated bacterial species from the single sort of instrument. The common bacteria isolated from the different instruments are in the overlapped areas of the diagrams. 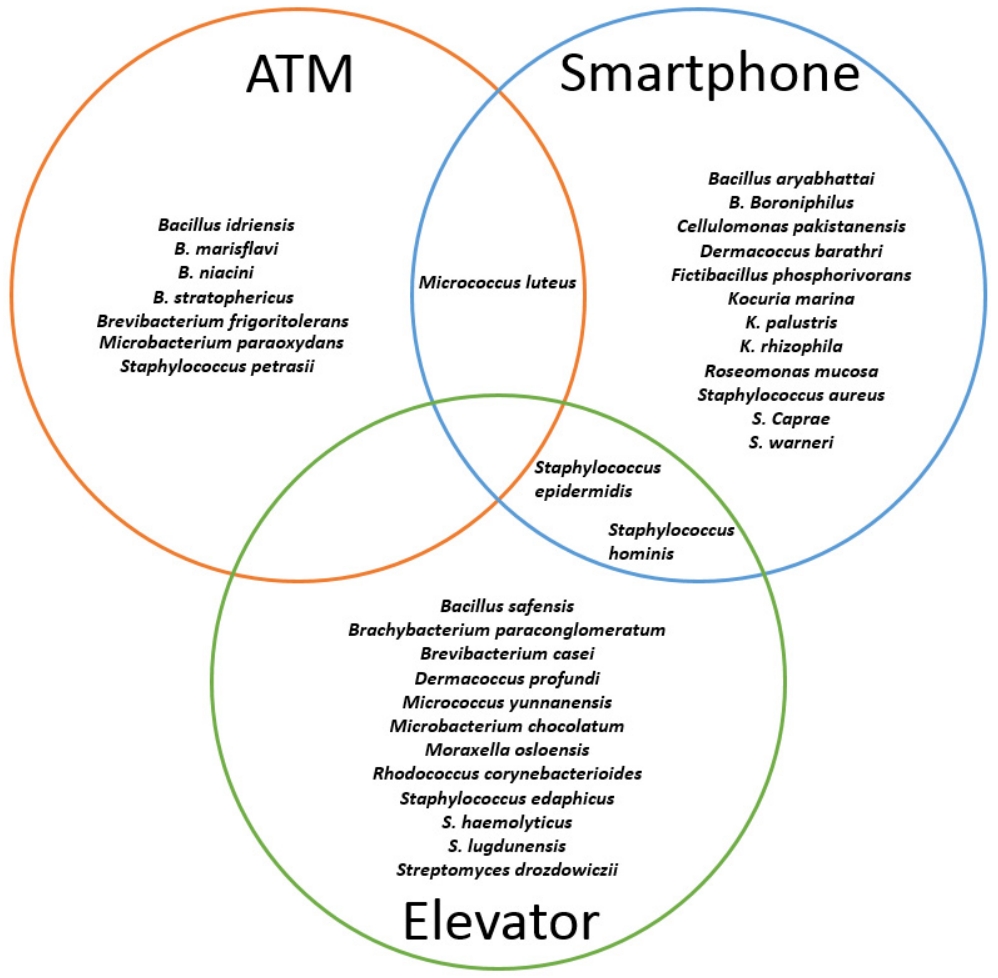
Fig. 8.
DGGE fingerprints of the samples obtained from elevator buttons (A), ATM screens (B), and smartphone surfaces (C). The bars in the figure indicate the visible bands in the fingerprint. 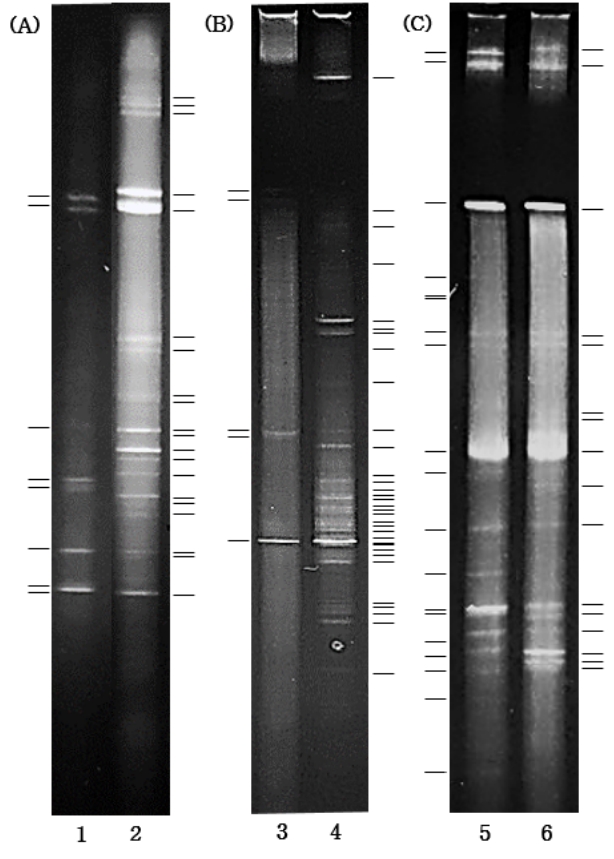
Table 1.
The ingredients of DGGE gel (polyacrylamide gel) used in this experiment.
|
Ingredient |
40% |
70% |
|
Acry/Bis |
4.03 mL |
4.03 mL |
|
50×TAE |
0.32 mL |
0.32 mL |
|
Urea |
2.68 g |
4.7 g |
|
Formamide (deionized) |
2.56 mL |
4.48 mL |
|
dH2O |
6.41 mL |
2.47 mL |
|
10% Ammonium Persulfate |
120 µL |
120 uL |
|
TEMED (Tetramethylethylenediamine) |
8 uL |
8 uL |
Table 2.
The culturable bacterial species isolated from elevator buttons.
|
Name |
Pathogenicity |
Remark |
Reference |
|
Bacillus safensis
|
- |
|
|
|
Brachybacterium paraconglomeratum
|
- |
|
|
|
Brevibacterium casei
|
+ |
∙ brain abscess |
[15] |
|
Dermacoccus profundi
|
- |
|
|
|
Micrococcus yunnanensis
|
- |
|
|
|
Microbacterium chocolatum
|
- |
|
|
|
Moraxella osloensis
|
+ |
∙ endocarditis |
[21] |
|
|
∙ meningitis |
|
|
|
∙ osteomyelitis |
|
|
|
∙ septic arthritis |
|
|
|
∙ vaginitis |
|
|
|
∙ bacteremia |
|
|
Rhodococcus corynebacterioides
|
+ |
∙ sepsis |
[20] |
|
Staphylococcus edaphicus
|
- |
|
|
|
S. epidermidis
|
+ |
∙ opportunistic pathogen |
[18] |
|
S. haemolyticus
|
+ |
∙ opportunistic pathogen |
[16] |
|
S. hominis
|
+ |
∙ opportunistic pathogen |
[17, 28] |
|
|
∙ sepsis |
|
|
S. lugdunensis
|
+ |
∙ soft tissue infection |
[19] |
|
Streptomyces drozdowiczii
|
- |
|
|
Table 3.
The culturable bacterial species isolated from ATM screens.
|
Name |
Pathogenicity |
Remark |
Reference |
|
Bacillus idriensis
|
- |
|
|
|
B. marisflavi
|
- |
|
|
|
B. niacini
|
- |
|
|
|
B. stratophericus
|
- |
|
|
|
Brevibacterium frigoritolerans
|
- |
|
|
|
Microbacterium paraoxydans
|
+ |
∙ bacteremia |
[25] |
|
Micrococcus luteus
|
+ |
∙ septic shock |
[26] |
|
|
∙ skin infection |
|
|
Staphylococcus petrasii
|
- |
|
|
Table 4.
The culturable bacterial species isolated from smartphone surfaces.
|
Name |
Pathogenicity |
Remark |
Reference |
|
Bacillus aryabhattai
|
- |
|
|
|
B. boroniphilus
|
- |
|
|
|
Cellulomonas pakistanensis
|
- |
|
|
|
Dermacoccus barathri
|
+ |
∙ blood stream infection |
[33] |
|
Fictibacillus phosphorivorans
|
- |
|
|
|
Kocuria marina
|
- |
|
|
|
K. palustris
|
- |
|
|
|
K. rhizophila
|
- |
|
|
|
Micrococcus luteus
|
+ |
∙ septic shock |
[26] |
|
∙ skin infection |
|
Roseomonas mucosa
|
+ |
∙ bacteremia |
[31] |
|
Staphylococcus aureus
|
+ |
∙ food poisoning |
[29] |
|
∙ purulent inflammation |
|
∙ enteritis |
|
S. caprae
|
+ |
∙ bones and joints infection |
[32] |
|
S. epidermidis
|
+ |
∙ opportunistic pathogen |
[18] |
|
S. hominis
|
+ |
∙ opportunistic pathogen |
[17, 28] |
|
∙ sepsis |
|
S. warneri
|
+ |
∙ bacteremia |
[30] |
References
2. Bank of Korea, 2017 Survey on the use of payment instruments pp. 6(2018).
3. Ministry of Science and ICT, Korea Internet & Security Agency, 2017 Survey on the internet usage pp. 8-11(2018).
4. Statistics Korea, 2017 Social indicators in Korea, 389(2017).
5. Y. G.. Zo, Comparison of microbiological risks in hand-contact surfaces of items in cafeteria versus items in other facilities in a college campus, Korean J. Microbiol., 49(1), 51-57(2013).  6. L.. Quinzio, M.. Blazeka, B.. Hartmanna, R.. Röhrig, B.. Wille, A.. Junger, G.. Hempelmann, Computers in anesthesia and intensive care: lack of evidence that the central unit serves as reservoir of pathogens, Int. J. Hyg. Environ. Health., 208, 299-304(2005).  7. K. K.. Kwon, S. M.. Yoon, C. H.. Choi, B. G.. Jeong, K. W.. Lee, D. H.. Yi, H. J.. Kim, Presence of bacteria and fungi in inner compartment of personal computers(PCs), J. Korean Soc. Environ. Eng., 29(6), 728-733(2007).
8. C. J.. Lee, S. K.. Lim, B. C.. Kim, W.. Park, Characterization of bacteria isolated from rotted onions, Kor. J. Microbiol. Biotechnol., 33(4), 248-254(2005).
9. P.. Zhang, B.. Yuan, M.. Xu, X.. Cao, L.. Xue, J.. Jiang, Evaluation of the effect of plant growth promoting endophytic bacteria from Pinellia ternata using an efficient organic silica hybrid monolithic column, J. Biobased Mater. Bio., 11(4), 282-290(2017).  10. K.. Egli, F.. Bosshard, C.. Werlen, P.. Lais, H.. siegrist, A. J. B.. Zehnder, J. R.. van der Meer, Microbial composition and structure of a rotating biological contactor biofilm treating ammonium-rich wastewater without organic carbon, Microb. Ecol., 45(4), 419-432(2003).  11. V. L.. Cono, F.. Smedile, G.. Bortoluzzi, E.. Arcadi, G.. Maimone, E.. Messina, M.. Borghini, E.. Oliveri, S.. Mazzola, S.. L’Haridon, L.. Toffin, L.. Genovese, M.. Ferrer, L.. Giuliano, P. N.. Golyshin, M. M.. Yakimov, Unveiling microbial life in new deep-sea hypersaline Lake Thetis. Part Ⅰ: Prokaryotes and environmental settings, Environ. Microbiol., 13(8), 2250-2268(2011).  12. Y. B.. Kim, S. H.. Na, S. Y.. Kim, H. H.. Lee, Biocide effects of wood vinegars against skin microorganisms, J. Naturopath., 1(1), 77-83(2012).
13. C. C.. de Foggi, A. L.. Machado, C. A.. Zamperini, D.. Fernandes, A. F.. Wady, C. E.. Vergani, Effect of surface roughness on the hydrophobicity of a denture-base acrylic resin and Candida albicans colonization, J. Investig. Clin. Dent., 7(2), 141-148(2016).  14. Z.. Gao, C. H.. Tseng, Z.. Pei, M. J.. Blaser, Molecular analysis of human forearm superficial skin bacterial biota, Proc. Natl. Acad. Sci., 104(8), 2927-2932(2007).  15. V. A.. Kumar, D.. Augustine, D.. Panikar, A.. Nandakumar, K. R.. Dinesh, S.. Karim, R.. Philip, Brevibacterium casei as a cause of brain abscess in an immunocompetent patient, J. Clin. Microbiol., 49(12), 4374-4376(2011).  16. E. S.. Jacob, H.. Prasanth, Multi drug resistant Staphylococcus haemolyticus an emerging nosocomial pathogen in neonatal sepsis at tertiary care centre, Thanjavur India, Int. J. Curr. Microbiol. App. Sci., 8(3), 528-535(2019).  17. S.. Jiang, B.. Zheng, W.. Ding, L.. Lv, J.. Ji, H.. Zhang, Y.. Xiao, L.. Li, Whole-genome sequence of Staphylococcus hominis, an opportunistic pathogen, J. Bacteriol., 194(17), 4761-4762(2012).  18. M.. Otto, Staphylococcus epidermidis–the "accidental" pathogen, Nat. Rev. Microbiol., 7(8), 555-567(2009).  19. L. A.. Heldt Manica, P. R.. Cohen, Staphylococcus lugdunensis infections of the skin and soft tissue: a case series and review, Dermatol. Ther. (Heidelb)., 7(4), 555-562(2017).  20. Y.. Kitamura, E.. Sawabe, K.. Ohkusu, N.. Tojo, S.. Tohda, First report of sepsis caused by Rhodococcus corynebacteroides in a patient with myelodysplastic syndrome, J. Clin. Microbiol., 50(3), 1089-1091(2012).  21. S. S.. Shah, A.. Ruth, S. E.. Coffin, Infection due to Moraxella osloensis: case report and review of the literature, Clin. Infect. Dis., 30(1), 179-181(2000).  22. G. Z.. Zhao, J.. Li, S.. Qin, Y. Q.. Zhang, W. Y.. Zhu, C. L.. Jiang, L. H.. Xu, W. J.. Li, Micrococcus yunnanensis sp. nov., a novel actinobacterium isolated from surface-sterilized Polyspora axillaris roots, Int. J. Syst. Evol. Microbiol., 59(Pt 10), 2383-2387(2009).  23. D.. Barnawal, N.. Bharti, A.. Tripathi, S. S.. Pandey, C. S.. Chanotiya, A.. Kalra, ACC-deaminase-producing endophyte Brachybacterium paraconglomeratum strain SMR20 ameliorates chlorophytum salinity stress via altering phytohormone generation, J. Plant Growth Regul., 35(2), 553-564(2015).  24. L. T.. Semêdo, R. C.. Gomes, A. A.. Linhares, G. F.. Duarte, R. P.. Nascimento, A. S.. Rosado, M.. Margis-Pinheiro, R.. Margis, K. R.. Silva, C. S.. Alviano, G. P.. Manfio, R. M.. Soares, L. F.. Linhares, R. R.. Coelho, Streptomyces drozdowiczii sp. nov., a novel cellulolytic streptomycete from soil in Brazil, Int. J. Syst. Evol. Microbiol., 54(PT 4), 1323-1328(2004).  25. M. S.. Chorost, N. C.. Smith, J. N.. Hutter, A. C.. Ong, J. A.. Stam, P. T.. McGann, M. K.. Hinkle, K. E.. Schaecher, E.. Kamaul, Bacteraemia due to Microbacterium paraoxydans in a patient with chronic kidney disease, refractory hypertension and sarcoidosis, JMM Case Rep., 5(11), 1-5(2018).  26. D.. Albertson, G. A.. Natsios, R.. Gleckman, Septic shock with Micrococcus luteus, Arch Intern Med., 138(3), 487-488(1978).  28. R. A.. Bowman, M.. Buck, Staphylococcus hominis septicaemia in patients with cancer, Med. J. Aust., 140(1), 26-27(1984).  29. P. J.. Jeong, D. H.. Kwak, Y. D.. Jo, Distribution of pathogenic bacteria and evaluation of microbiological security in drinking water, in Proceedings of the Annual Meeting of Korean Society of Environmental Engineers, KSEE. Yeungnam university, Gyeongsan, 721-724(1995).
30. U.. Kamath, C.. Singer, H. D.. Isenberg, Clinical significance of Staphylococcus warneri bacteremia, J. Clin. Microbiol., 30(2), 261-264(1992).
31. Y. K.. Kim, J. S.. Moon, K. E.. Song, W. K.. Lee, Two cases of bacteremia due to Roseomonas mucosa, Ann. Lab. Med., 36(4), 367-370(2016).  32. A.. Gowda, A. L.. Pensirero, C. D.. Packer, Staphylococcus caprae: a skin commensal with pathogenic potential, Cureus., 10(10), 1-8(2018).  33. N.. Takahashi, M.. Shinjoh, H.. Tomita, A.. Fujino, K.. Sugita, Y.. Katohno, T.. Kuroda, K.. Kikuchi, Catheter-related blood stream infection caused by Dermacoccus barathri, representing the first case of Dermacoccus infection in humans, J. Infect. Chemother., 21(8), 613-616(2015).  34. S. W.. Hong, I. K.. Lim, Y. W.. Kim, S. M.. Shin, K. S.. Chung, Denaturing gradient gel electrophoresis and culture-based analysis of the bacterial community in Cheonggukjang, a Korean traditional fermented soybean food from Gangwon province, Korean J. Food Sci. Technol., 45(4), 515-520(2013). 
|
|


















