The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
폐목재로부터 리그닌 추출을 위한 Organosolv 전처리공정의 최적화
Abstract
The purpose of this study was to optimize experimental conditions (time (X1) (ranging of 26.36 - 93.64 min), concentration of sulfuric acid (X2) (ranging of 0-2.5%) and temperature (X3) (ranging of 136.4 - 203.6℃) for an organosolv pretreatment process to extract lignin from waste wood. The resulting quadratic model equation using RSM (response surface methodology) represented y (lignin yield) = -79.89 + 0.91X1 + 9.8X2 - 2.54 × 10-3X12 - 2.11X22. The R2 (coefficient of determination) value of 0.8531 for a model indicates this model has statistically significant predictors at the 10% levels. The predictive results optimized by quadratic model produced a lignin yield of 12.46 g/100 g of dry wood under conditions of 178.2℃ and 2.32% H2SO4. The lignin yield was more affected by the acid catalyst concentrations than the reaction temperature, but the reaction time was not an influential factor for improving lignin extraction from waste wood in this organosolv pretreatment. According to ANOVA (analysis of variance), the significance probability (p-value) of model was smaller than 0.001 and simulation of obtained model equations showed a good reproducibility based on actual organosolv tests under optimal conditions.
Key words: Waste wood, Lignin, Organosolv Process, Optimization, CCD (Central Composite Design), RSM (Response Surface Methodology)
요약
본 연구는 폐목재로부터 organosolv 공정을 이용해서 리그닌을 분리할 때 영향을 미치는 주요 3개의 반응조건(반응 시간(X1), 산 촉매의 농도(X2) 및 반응온도(X3))을 리그닌 회수율(y) 기준으로 최적화하였다. 중심합성계획법(central composite design, CCD)에 따라 반응온도 136.4-203.6℃, 산촉매 농도 0-2.5%, 반응시간 26.36-93.64 분의 범위를 가진 실험계획을 수행해서 2차 모델식 및 최적조건을 수립하였다. 2차 모델식은 y = -79.89+0.91X1+9.8X2-2.54×10-3X12-2.11X22와 같이 얻었으며, 결정계수(coefficient of determination, R2) 값은 0.8531으로 10% 이내의 유의수준에서 유의성을 나타냈다. 2차 모델식에 따라 예측되는 최고 리그닌 회수율은 12.46 g/100 g of dry wood이며 이때 최적 반응 조건은 반응온도 178.2℃, 산 촉매 농도 2.32%으로 나타났다. 폐목재 대상 organosolv 공정에서의 리그닌 수율은 반응온도보다는 산 촉매 농도의 영향이 더 크게 나타났으며 반응시간에 의한 영향은 없는 것으로 나타났다. 모델의 변동성 분석(analysis of variance, ANOVA)에 따르면 리그닌 수율(y)에 대한 모델식의 유의확률은 p<0.001로 높은 유의성을 보였다. 최적조건에서 모델의 재현성을 검증한 결과 모델식이 실제공정을 적절하게 모사한 것으로 나타났다.
주제어: 폐목재, 리그닌, organosolv 공정, 최적화, 중심합성계획법, 반응표면분석
1. 서 론
바이오매스는 지속가능한 에너지원 중 하나로 그 종류에 따라 다양한 공정을 거쳐서 바이오연료나 바이오가스를 생산하는데 이용된다. 바이오매스 중 많은 부분을 차지하는 목질계 바이오매스는 목재, 볏짚, 기타 농업 관련 폐기물 등이 있으며 주로 셀룰로오스와 헤미셀룰로오스 및 리그닌으로 구성되어있다[ 1, 2]. 바이오매스에서 유래한 셀룰로오스는 바이오에탄올 및 원료용 글루코오스로 이용되고 있다. 상업적으로는 주로 옥수수와 사탕수수를 이용해서 바이오연료를 생산중이지만 이러한 식용작물이용은 식량부족 및 곡물가격 상승 등의 문제를 야기할 수 있다[ 3, 4]. 이에 따라 비식용 목질계 바이오매스를 이용한 바이오연료 생산에 대해 관심이 높아지고 있는 상황이다. 셀룰로오스와 달리 리그닌은 이용가치가 적은 펄프 생산 공정의 부산물로 인식되었다. 이러한 인식하에서 리그닌은 주로 공정에 필요한 열에너지를 공급하는 단순 연료로 이용되어왔다. 하지만 목질계 바이오매스의 효율적인 이용을 위한 연구가 진행됨에 따라 리그닌을 페놀 수지, 에폭시 수지, 접착제 등의 화학약품화 및 탄소섬유로 소재화하는 등의 리그닌 부가가치화 연구사례가 많아지고 있다[ 5]. 본 연구에서 대상으로 하는 폐목재는 국내에서 2015년 기준 생활폐기물계 59.4만 톤, 사업장배출계 84.3만 톤, 건설폐기물계 33.3만 톤 등 연간 177여만 톤이 발생되며 재활용률은 약 70% 정도이다[ 6]. 폐목재는 오염된 정도에 따라 1~3등급으로 분류된다[ 7]. 1등급 폐목재는 이물질에 의해 오염되지 않은 형태의 폐목재로 재활용용도의 범위가 제일 넓다[ 7]. 반면 2·3등급 폐목재는 가공과정에서 페인트, 기름, 방부제, 할로겐족 유기화합물 등에 의해서 오염된 폐목재로 높은 회분 함량을 가진다[ 7, 8]. 이러한 특성으로 인해 소각․매립 처리 시 규정농도 이상의 일산화탄소, 질소산화물, 미세먼지, 다이옥신 및 중금속 등의 대기오염물질이 발생되며, 장마 등의 우기에 노출될 경우 폐목재에 포함되어있는 접착제 및 마감제 등에서 유해물질이 용출되기 때문에 주요 오염발생원으로 작용될 수 있다[ 9]. 따라서 폐목재의 재활용 활성화를 위해 폐목재로부터 물질 재생 및 에너지 회수 관련 연구가 요구되고 있다. 바이오매스로부터 연료를 생산하는 공정에서는 셀룰로오스 및 헤미셀룰로오스로부터 리그닌을 분리하기 위한 전처리가 선행되어야 한다. 이러한 전처리 공정은 방식에 따라 생물학, 물리학, 물리화학적인 공정들로 분류된다. 이들 대표적인 공정 중에서 organosolv 공정은 kraft 공정[ 10], lignosulfite 공정[ 11] 등과 함께 대표적인 물리화학적 전처리 공정으로 목질계 바이오매스를 메탄올, 에탄올 또는 아세톤 등의 유기용매와 혼합하여 고온에서 처리하는 공정이다[ 12]. 반응 온도를 낮추고 탈리그닌화 반응을 향상시키기 위해서 황산 또는 염산과 같은 무기산을 촉매로 사용하기도 한다[ 13, 14]. 이 공정에서 사용하는 유기용매는 물보다 끓는점이 낮기 때문에 전처리가 끝난 후 증류를 이용한 용매회수 후 재사용할 수 있다는 장점이 있다[ 13]. 목질계 바이오매스를 원재료로 한 organosolv 전처리 공정 최적화 연구는 국내·외에서 사시나무(poplar) [ 15], 로지폴 소나무(lodgepole pine) [ 16] 등 목재를 대상으로 한 연구와 팜 찌꺼기(empty palm fruit bunch) [ 17], 유채짚(rapeseed straw) [ 18], 보릿짚(barley straw) [ 19] 등의 농업폐기물을 대상으로 한 사례들이 존재한다. 일반적으로 organosolv 공정은 반응온도 180-195℃, 반응시간 30-90분, pH 2.0-3.8에서 잘 진행된다고 알려져 있다[ 20]. 이에 따라 위 연구사례들에서는 반응온도, 반응시간 및 pH에 영향을 주는 산촉매의 농도를 독립변수로 설정하여 최적의 리그닌수율을 나타내는 조건을 찾고 변수 간 관계 모델을 도출해 냈다. 현재 국내·외에서 2·3등급 폐목재 대상으로 organosolv 전처리 공정을 최적화한 연구는 아직까지 시도되지 않아, 본 연구에서는 2·3등급 폐목재를 대상으로 organosolv 전처리 공정에 영향을 미치는 반응온도, 반응시간 및 산 촉매의 농도를 주요인자로 설정하여 반응표면분석법(response surface methodology, RSM)을 통해 리그닌 회수율에 대한 정량적 인자특성, 상호작용, 반응 모델 및 최적 반응조건을 찾기 위한 연구를 수행하였다.
2. 연구재료 및 방법
2.1. 실험재료
폐목재는 2016년 광주광역시 하남산업단지 내에 위치한 폐기물 재활용 업체에서 분쇄된 2·3등급 폐목재를 제공받아서 사용하였다. 이 업체에는 광주·전남지역에서 약 30-80톤/일의 사업장배출 및 건설폐기물계 2·3등급 폐목재가 유입된다. 이는 2015년 기준 폐목재 총 발생량의 0.7-1.8%이며 광주 전남지역 사업장배출 및 건설폐기물계 폐목재 발생량의 11.4-30.5%를 나타낸다.
폐목재는 NREL/TP-510-42620에 따라서 수분함량 10% 미만으로 건조시켰으며, 분쇄기를 이용한 추가 분쇄 후 체를 사용해서 150-850 µm의 입자를 분리했다. Organosolv 전처리에 사용한 에탄올은 OCI (Incheon, Korea)에서, 황산은 Daejung chemicals & Materials Co. (Siheung, Korea)에서 제조된 제품을 구입하여 사용하였다. 초순수는 Merck Millipore Co. (Darmstadt, Germany)사의 Direct-Q® ultrapure water Type 1 기기에서 제조된 것을 사용했다.
2.2. 원재료 분석
폐목재의 수분[ 21], 회분[ 22], 리그닌[ 23, 24], 탄수화물[ 23, 24], 및 extractives[ 25] 함량은 NREL (National Renewable Energy Laboratory, Golden, CO, USA)와 TAPPI (Technical Association of the Pulp and Paper Industry, Peachtree Corners, GA, USA)에서 제시하는 절차에 의해 분석되었다.
2.3. Organosolv 공정
에탄올 수용액(65%, v/v)을 organosolv 공정에 사용하였다. 목재와 총 혼합물의 무게비율을 1:10 (30 g:300 g)으로 하여 Fig. 1과 같은 반응기에서 전처리를 실시하였다. 반응기의 용량은 1 L이었으며, CHEMRE SYSTEM Inc. (Anyang, Korea)에서 R-101모델을 기반으로 제작하여 사용하였다. 실험 후 나온 펄프와 액체분리를 위해서 whatman grade 1 filter paper를 이용하여 감압여과를 실시하였으며, 펄프는 초순수 600 mL로 세척하였다. 세척액과 여과액을 혼합하여 리그닌을 침전시킨 후, 리그닌 침전액을 감압여과하여 얻어진 리그닌의 감압여과 전, 후 무게차이를 이용해서 수율을 계산했다. 리그닌 수율은 2회 반복 실험하여 다음과 같은 식 (1)에 따라 계산되었다. 리그닌 분리율은 식 (2)에 따라서 계산되었다.
2.4. 통계학적 실험설계 및 분석
본 연구에서는 폐목재를 대상으로 한 organosolv 공정조건의 최적화를 위해 반응표면 분석법 Response Surface Methodology을 사용하였다. 반응온도(℃), 황산의 농도(%) 및 반응시간(min) 등 세 조건을 독립변수, 리그닌 수율을 종속변수로 설정해서 회전 가능한 중심합성계획법 CCD, central composite design을 사용하여 실험계획을 세웠다( Table 1). 임의순서에 따라 실험을 수행하였으며, 실험결과들을 이용하여 다음과 같은 2차 모델식 (3)을 기반으로 리그닌 수율 예측 모델식을 완성하였다. 모델식 내 y는 종속변수(리그닌 수율, wt%), β0, βi. βii, βij는 반응모델식의 계수이며 Xi, Xj는 독립변수를 의미한다. Design-Expert (Version 7.0.0, Stat-Ease Inc., Minneapolis, MN, US) 프로그램을 사용하여 반응표면분석 RSM, response surface analysis, 변동성 분석(analysis of variance, ANOVA) 및 2차원 그래프 작성을 수행하였다.
3. 결과 및 고찰
3.1. 원재료의 조성
본 실험에 사용된 원재료 폐목재를 분석한 화학적 조성 결과를 타 연구에서 사용되었던 바이오매스의 화학적 조성과 비교하기 위하여 Table 2에 함께 제시하였다. 본 연구에서 사용한 폐목재의 회분 함량은 17.7%로 Table 2에 제시된 일반목재들에 비해서 매우 높은 회분 함량을 보였고, glucose와 xylose는 각각 29.44%, 6.25%로 일반목재들과 비교해서 낮은 함량을 나타냈다. 전체 리그닌 함량은 28.16%로 일반목재와 비슷한 함량을 나타냈다.
3.2. 리그닌 회수율 반응모델 수립
중심합성계획법에 따라 수행된 실험결과는 Table 3에 제시하였다. 수행한 실험 중 리그닌 수율이 11.5% 이상으로 나타난 조건은 4번 실험(반응온도 190℃, 산 촉매 농도 2.0%, 반응시간 40분), 8번 실험(반응온도 190℃, 산 촉매 농도 2.0%, 반응시간 80분), 12번 실험(반응온도 170℃, 산 촉매 농도 2.5%, 반응시간 60분)이었다. 반면 2% 미만의 적은 수율을 나타낸 조건은 1번 실험(반응온도 150℃, 산 촉매 농도 0.5%, 반응시간 40분), 11번 실험(반응온도 170℃, 산 촉매 농도 0%, 반응시간 60분)으로 밝혀졌다. 실험 수행 결과를 바탕으로 organosolv 공정을 통해 얻어지는 리그닌 수율(y)에 대한 반응온도(X 1), 황산의 농도(X 2) 및 반응시간(X 3)과의 관계를 식 (3)과 같이 2차식 형태의 모델로 묘사하였다. 2차 모델식 (4)의 결정계수(coefficient of determination, R 2) 값은 0.8531로 10% 이내의 유의수준에서 통계적 유의성이 인정되었다. 해당 항별 (선형, 교호항, 순수이차)인자에 대한 유의성 및 효과를 확인한 결과 교호항(X 1X 2, X 2X 3, X 3X 1) 및 반응시간 관련항(X 3, X 32)은 통계적으로 유의하지 않아 후방소거법에 의해 제거되었다. 선형조건에서는 황산의 농도(X 2)가 organosolv 공정 내에서 폐목재로부터 리그닌을 회수(y)하는데 가장 큰 영향을 주는 것으로 나타났다. 중심점(반응온도 170℃, 산 촉매 농도 1.25%, 반응시간 60분)에서 실험인자들의 수준변경에 따른 리그닌 수율에 대한 이들의 영향을 선형 및 비선형 효과의 차이를 계산하여 판단한 결과( Fig. 2), 반응온도의 경우 178.2℃일 때 폐목재로부터 organosolv 공정의 리그닌 수율은 10.03 g/100 g of dry wood로 가장 높게 나타났다( Fig. 2(a)). 산 촉매 농도는 초기 수준에서 농도가 증가할수록 리그닌 수율이 가파르게 증가하다가 2.32% 이상의 농도부터는 리그닌 수율 12.29 g/100 g of dry wood에서 더 이상 증가되지 않았다( Fig. 2(b)). 따라서 황산 농도가 약 2.3% 정도일 때 충분히 폐목재 내의 여러 화합물로부터 리그닌을 회수할 수 있다고 판단되었다. 2차원 등고선 그래프를 통해 반응온도와 산 촉매 농도가 리그닌 수율에 미치는 영향을 살펴본 결과, 반응온도 178.2℃, 산 촉매 농도 2.32%에서 최대 리그닌 수율 12.46 g/100 g of dry wood이 제시되었으며( Fig. 2(c)) 이 때 리그닌 분리율은 44.25%로 나타났다. 사시나무를 원재료로 한 organosolv 공정 최적화 연구에서는 반응온도 155-205℃, 반응시간 26-94분, 산 촉매 농도 0.83-1.67%, 에탄올 농도 25-75%의 범위에서 실험을 진행하였다[ 15]. 제시된 실험범위 내에서 최적점이 정해진 조건은 반응온도(195℃)뿐이었으며, 반응시간 및 산 촉매의 농도는 범위 내에서 리그닌 수율과 선형 관계를 보임에 따라 최적조건은 제시되지 않았다. 반응시간은 본 연구에서와 같이 모델링과정에서 완전히 제거될 정도는 아니지만 리그닌 수율에 근소한 영향만을 주었다. 실험점 중 가장 높은 리그닌 수율을 나타낸 8번 실험점(반응온도 195℃, 반응시간 80분, 황산의 농도 1.5%, 에탄올 농도 65%)에서의 리그닌 수율은 20.90 g/100 g of dry wood 였으며, 리그닌 분리율은 89%였다. 소나무좀벌레에 의해 죽은 로지폴 소나무를 원재료로 한 organosolv 공정 최적화 연구에서는 반응온도 153-187℃, 반응시간 43-77분, 산 촉매 농도 0.76-1.44%, 에탄올 농도 48-82%의 범위에서 실험을 진행하였다[ 16]. 이 연구에서는 본 연구와 같이 모델링 과정에서 반응시간항이 제거되었으며, 반응온도 및 산 촉매 농도는 리그닌 회수율과 선형 관계를 보임에 따라 최적조건이 제시되지 않았다. 실험점 중 가장 높은 리그닌 수율을 나타낸 8번 실험점(반응온도 180℃, 반응시간 70분, 황산의 농도 1.30%, 에탄올 농도 75%)에서의 리그닌 수율은 24.96 g/100 g of dry wood였으며, 리그닌 분리율은 98%였다. 이 두 연구사례와 본 연구의 리그닌 분리율이 차이를 보이는데 이것은 organosolv 공정의 세부공정조건(원재료:혼합반응물의 비율) 및 리그닌 침전법이 다르기 때문이다. 그러므로 리그닌 수율 및 분리율 수치를 직접 비교하기보다는 원재료에 따라서 독립변수가 리그닌 수율에 어떻게 영향을 미치는 지를 비교·분석하였다. 두 목재 연구사례와 본 연구를 비교했을 때 목재종류와 관계없이 organosolv 공정에 주요 영향을 미치는 반응시간은 일반적으로 적용되는 범위 내에서는 리그닌 수율에 큰 영향을 미치지 않는 것으로 보였다. 산 촉매 농도는 두 연구사례 모두 실험범위 내에서 농도가 높아질수록 리그닌 수율도 함께 증가되었다. 본 연구에서는 목재 대상 실험에서 산 촉매 농도의 최적값이 존재하는지 알아보기 위해 농도범위를 기존 연구보다 넓게 설정하고 연구를 진행한 결과 2.32%라는 최적값을 얻을 수 있었다. 반응온도의 경우 본 연구와 연구사례의 최적조건이 약 15℃ 정도 차이가 나지만 180-200℃내에서 최적조건이 형성되어 일반적으로 organosolv 전처리 공정이 잘 이루어지는 온도 범위와 크게 다르지 않았다. 폐목재를 구성하는 목재의 종류는 수집 시기 및 지역에 따라 변동이 발생하지만, 이전 연구 사례들을 고려해볼 때 본 연구에서 제시한 폐목재 대상 organosolv 공정 내 주요 인자들의 최적 조건은 크게 달라지지 않을 것으로 판단된다.
3.3. 리그닌 회수율 반응모델 검증
반응표면분석에 의해 도출된 모델의 예측 결과의 정확성을 평가하기 위하여 본 연구에서 도출된 최적조건(반응온도 178.2℃, 산 촉매 농도 2.32%, 반응시간 60분)으로 organosolv 공정을 통한 리그닌 회수 실험을 다시 진행하였다. 반응시간은 모델에 유의미한 영향을 주지 못하여 본 모델식 (4)에서 제외되었기 때문에 실험설계에서 시간 범위의 중간점인 60분을 임의로 선택하였다. 제시된 최적조건에서 예상되는 리그닌 회수율은 12.46 g/100g of dry wood이었으며, 실험을 통해 얻어진 리그닌 회수율은 12.36 g/100g of dry wood으로 약 1% 이내의 오차범위에서 거의 유사한 결과를 보였다. 반응표면분석을 통해 얻어진 2차 모델식 (4)의 오차항에 대한 잔차분석을 통하여 모델의 적합 정도를 판단하였다( Fig. 3). 제시된 모델은 정규 확률 그래프에서 모든 데이터들이 잔차 ±2.6 내에서 직선적으로 분포됨에 따라 정규분포를 나타내었다( Fig. 3(a)). 잔차와 예측값의 산점도의 경우 ±2.6 내에서 무작위로 퍼져있는 것으로 보아 오차가 등분산성을 만족하고 있으며( Fig. 3(b)) 실험수행순서에 따른 잔차 데이터 순서의 경우 ±2.6 내에서 상하로 무작위적인 분포되고 있는 것을 확인할 수 있었다( Fig. 3(c). 따라서 잔차분석의 결과 오차항들의 정규성, 등분산성, 독립성 및 선형성을 모두 만족하여 제시된 모델에 문제가 없는 것으로 판단되었다. 반응표면분석에 의해 도출된 리그닌 수율(y) 2차 모델식 (4)의 회귀분석 및 변동성분석(ANOVA)결과는 Table 4에 제시하였다. 리그닌 수율(y)에 대한 식 (4)의 유의확률은 p< 0.001로 매우 유의하게 나타났다. Table 4에 제시된 수치는 각각의 요인이 측정치에 어떻게 영향을 주는가를 의미한다. p 수치는 각 계수의 중요성을 확인하는 도구로 사용되고 각 독립변수 간의 상호 작용 강도를 표시하는데 사용된다. 본 2차 회귀모델식 (4)의 p 수치는 p<0.001로 낮은 값을 보였는데 이는 낮은 확률의 F test 값을 의미하므로 본 모델이 매우 유의하다는 것을 증명한다( Table 4). 모델 F 수치가 17.42라는 의미는 본 모델이 중요하다는 것을 암시하고 있으며 모델 F 수치가 noise가 발생할 확률이 0.1% 미만으로 매우 낮다는 것을 의미한다. 모델의 적합성 결여 검정(Lack of fit)의 결과 유의확률이 0.7657로 0.05보다 큰 값을 나타내어 모델이 적합하였으며, 회귀모델의 유효성과 정확성을 판단하는 결정계수(R 2) 값은 0.8531로 종속변수의 85% 확률로 설명이 가능한 상관관계를 보였다. 한편 반응온도와 관련한 X 1, X 12의 유의확률은 각각 0.0866, 0.0518로 유의수준 10% 이내의 유의성을 나타냈으며, 산 촉매 농도와 관련한 X 2, X 22는 각각 p<0.0001, p<0.05으로 리그닌 수율(y)에 가장 큰 영향을 주는 것으로 나타났다.
4. 결 론
본 연구는 반응표면분석법을 이용하여 organosolv 공정으로부터 저등급 폐목재 내 리그닌을 추출하는데 있어 주요 공정인자(반응온도, 산 촉매 농도, 반응시간)들의 영향성을 분석하고 이들의 최적 조건을 도출하고자 하였다. 연구를 수행한 결과는 다음과 같다.
1) 폐목재의 리그닌 함량은 다른 목질계 바이오매스와 비교해서 큰 차이가 없는 것으로 조사되어 폐목재는 리그닌 생산을 통한 자원화 대상으로 적합할 것으로 판단되었다.
2) 리그닌 수율 기준으로 폐목재 대상 organosolv 공정 최적조건은 반응온도 178.2℃, 산 촉매의 농도 2.32%로 제시되었으며, 이때 예상되는 리그닌 회수율은 12.46 g/100 g of dry wood이었다. 도출된 최적 조건에서 실제 추출된 리그닌 회수율은 12.36 g/100 g of dry wood로 모델이 비교적 실제 공정을 잘 모사하는 것으로 나타났다.
3) 리그닌 수율(y)에 대한 2차 모델식의 결정계수 R2은 0.8531로 10% 이내의 유의수준에서 유의성이 인정되었으며 유의확률이 p<0.001로 높은 유의성을 나타내었다.
4) 잔차분석 결과 정규성(normality), 등분산성(equal variation), 독립성(independence), 선형성(linearity)을 모두 만족하여 모델에 문제가 없는 것으로 나타났다.
Acknowledgments
본 연구는 국토교통부 국토교통기술촉진연구사업의 연구비 지원(17CTAP-C114619-02)에 의해 수행되었습니다.
Fig. 1.
A reactor designed to mimic an organosolv process. 
Fig. 2.
Effects of (a) sulfuric acid (SA); (b) temperature; (c) both SA and temperature on lignin yields in an organosolv process. 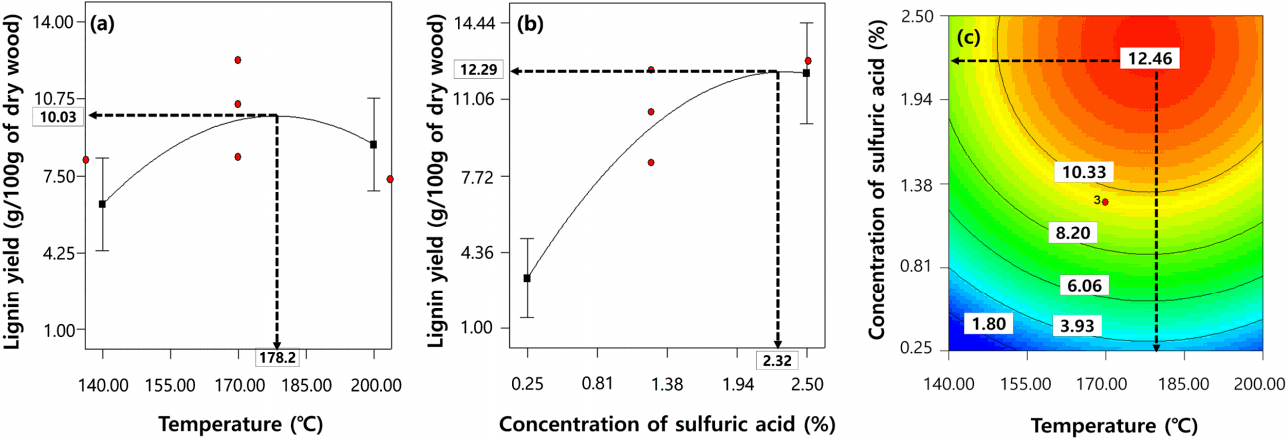
Fig. 3.
Residual plots of model for error values: (a) normal probability plot of the residuals; (b) residuals and predicted response plot; (c) residuals and run number plot. 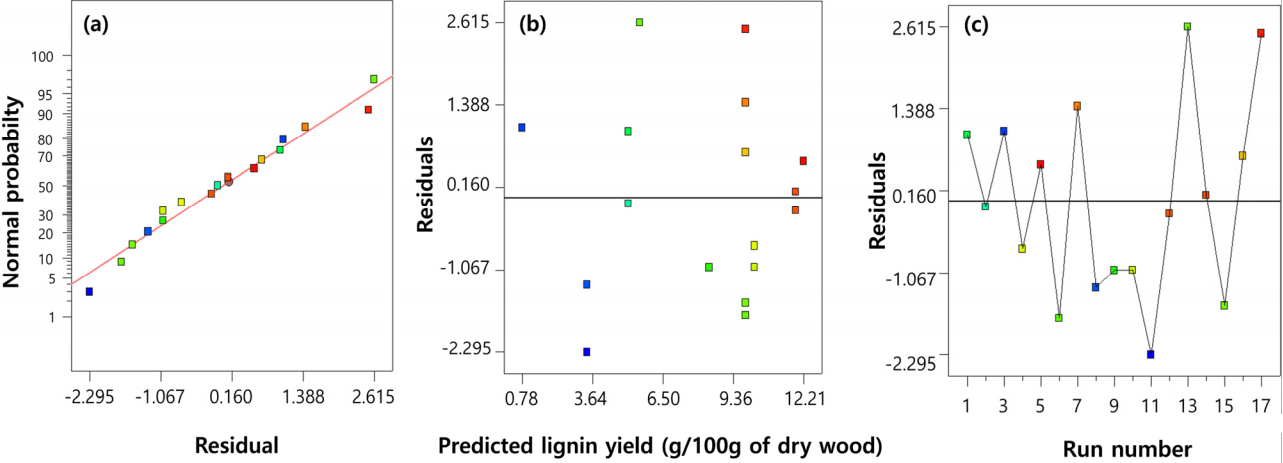
Table 1.
Levels of independent variables
|
Level |
Code |
Explanatory Variables
|
|
Temperature (℃) |
Concentration of SAa) in mixture (% w/w) |
Reaction time (min) |
|
+Alpha |
+1.68179 |
203.6 |
2.5 |
93.64 |
|
Max |
+1 |
190 |
2. |
80 |
|
Central level |
0 |
170 |
1.25 |
60 |
|
Min |
-1 |
150 |
0.5 |
40 |
|
-Alpha |
-1.68179 |
136.4 |
0 |
26.36 |
Table 2.
Characteristics of raw materials
|
Component |
Waste wood |
Poplar [15] |
Athel pine [26] |
Eucalyptus [26] |
|
Ash |
17.70±1.30 |
- |
5.43 |
2.14 |
|
Acid soluble lignin |
1.57±0.03 |
2.30±0.03 |
4.45 |
2.45 |
|
Acid insoluble lignin |
26.59±0.26 |
20.95±0.84 |
25.97 |
32.73 |
|
Glucose |
29.44±1.98 |
48.95±1.21 |
49.34 |
44.45 |
|
Xylose |
6.25±0.28 |
17.85±0.40 |
11.82 |
10.53 |
|
Mannose |
3.41±0.33 |
3.88±0.01 |
0.27 |
0.28 |
|
Galactose |
0.94±0.003 |
0.38±0.01 |
0.46 |
2.24 |
|
Arabinose |
0.47±0.0005 |
0.26±0.01 |
0.68 |
0.82 |
Table 3.
Central composite design with three independent variables
|
Stda) order |
Temperature (℃)
|
Concentration of SAb) in mixture (% w/w)
|
Reaction time (min)
|
Lignin yield, % of dry wood
|
|
Coded value |
Real value |
Coded value |
Real value |
Coded value |
Real value |
actual value |
predicted value |
|
1 |
-1 |
150 |
-1 |
0.5 |
-1 |
40 |
1.117 |
3.364 |
|
2 |
+1 |
190 |
-1 |
0.5 |
-1 |
40 |
5.002 |
5.040 |
|
3 |
-1 |
150 |
+1 |
2 |
-1 |
40 |
9.499 |
10.159 |
|
4 |
+1 |
190 |
+1 |
2 |
-1 |
40 |
11.974 |
11.836 |
|
5 |
-1 |
150 |
-1 |
0.5 |
+1 |
80 |
2.127 |
3.364 |
|
6 |
+1 |
190 |
-1 |
0.5 |
+1 |
80 |
6.083 |
5.040 |
|
7 |
-1 |
150 |
+1 |
2 |
+1 |
80 |
9.185 |
10.159 |
|
8 |
+1 |
190 |
+1 |
2 |
+1 |
80 |
11.696 |
11.836 |
|
9 |
-1.68179 |
136.4 |
0 |
1.25 |
0 |
60 |
8.1745 |
5.634 |
|
10 |
+1.68179 |
203.6 |
0 |
1.25 |
0 |
60 |
7.355 |
8.451 |
|
11 |
0 |
170 |
-1.68179 |
0 |
0 |
60 |
1.8305 |
0.956 |
|
12 |
0 |
170 |
+1.68179 |
2.5 |
0 |
60 |
12.758 |
12.282 |
|
13 |
0 |
170 |
0 |
1.25 |
-1.68179 |
26.36 |
8.112 |
9.527 |
|
14 |
0 |
170 |
0 |
1.25 |
+1.68179 |
93.64 |
10.398 |
9.527 |
|
15 |
0 |
170 |
0 |
1.25 |
0 |
60 |
8.296 |
9.527 |
|
16 |
0 |
170 |
0 |
1.25 |
0 |
60 |
10.527 |
9.527 |
|
17 |
0 |
170 |
0 |
1.25 |
0 |
60 |
12.371 |
9.527 |
Table 4.
Analysis of variance (ANOVA) for the fitted model
|
Source |
SSa)
|
d.fb)
|
Mean square |
F value |
p-value Prob>F |
|
model |
191.95 |
4 |
47.99 |
17.42 |
<0.001 |
|
X1
|
9.60 |
1 |
9.60 |
3.48 |
0.0866 |
|
X2
|
157.67 |
1 |
157.67 |
57.23 |
<0.0001 |
|
X12
|
12.84 |
1 |
12.84 |
4.66 |
0.0518 |
|
X22
|
17.37 |
1 |
17.37 |
6.30 |
0.0274 |
|
Residual |
33.06 |
12 |
2.76 |
|
|
|
Lack of fit |
24.73 |
10 |
2.47 |
0.59 |
0.7657 |
|
pure error |
8.33 |
2 |
4.16 |
|
|
References
1. H.. Jørgensen, J. B.. Kristensen, C.. Felby, Enzymatic conversion of lignocellulose into fermentable sugars: challenges and opportunities, Biofuels. Bioprod. Biorefin., 1(2), 119-134(2007).  2. N.. Akhtar, K.. Gupta, D.. Goyal, A.. Goyal, Recent advances in pretreatment technologies for efficient hydrolysis of lignocellulosic biomass, Environ. Prog. Sustain. Energy., 35(2), 489-511(2016).  3. A. J.. Ragauskas, C. K.. Williams, B. H.. Davison, G.. Britovsek, J.. Cairney, C. A.. Eckert, The Path Forward for Biofuels and Biomaterials, Science., 311, 484-489(2006).  4. S. K.. Cho, M. Y.. Ju, Ethanol development and food security: Brazil and the U.S.A, Iberoamérica., 14(2), 147-192(2012).
5. S.. Laurichesse, L.. Avérous, Chemical modification of lignins: towards biobased polymers, Prog. Polym. Sci., 39(7), 1266-1290(2013).  6. Ministry of Environment, Status of waste genertion and disposal in Korea Ministry of Environment pp. 21-517(2016).
7. Ministry of Environment, Notification No. 2016-32 of the Ministry of Envirionment, Classfication and recycling standards of wastewood Korea Ministry of Government Legislation pp. 1-3(2016).
8. Younsei University UIF, Study on emission characteristics of air pollutants for energy recovery of wastewood, Nat. Inst. Environ. Res., 19, 89(2008).
9. Younsei University UIF, Study on emission characteristics of air pollutants for energy recovery of wastewood National Institute of Environmental Research pp. 52-106(2008).
10. USEPA, Review Of New Source Performance Standards For Kraft Pulp Mills U. S. Environmental Protection Agency(1983).
11. K. V.. Sarkanen, C. H.. Ludwig, Lignins: occurrence, formation, structure, and reactions Wiley-Interscience pp. 597-637(1971).
12. H. W.. Blanch, B. A.. Simmons, D.. Klein-Marcuschamer, Biomass deconstruction to sugars, Biotechnol. J., 6(9), 1086-1102(2011).  13. A. W.. Bhutto, K.. Qureshi, K.. Harijan, R.. Abro, Insight into progress in pre-treatment of lignocellulosic biomass, Energy., 122, 724-745(2017).  14. G.. Hu, J.. Heimann, O. J.. Rojas, Feedstock pretreatment strategies for producing ethanol from wood, bark, and forest residues, BioResour., 3(1), 270-294(2008).
15. X.. Pan, N.. Gilkes, J.. Kadla, K.. Pye, S.. Saka, D.. Gregg, K.. Ehara, D.. Xie, D.. Lam, J.. Saddler, Bioconversion of hybrid poplar to ethanol and co-products using an organosolv fractionation process: Optimization of process yields, Biotechnol. Bioeng., 94(5), 851-861(2006).  16. X.. Pan, D.. Xie, R. W.. Yu, D.. Lam, J. N.. Saddler, Pretreatment of lodgepole pine killed by mountain pine beetle using the ethanol organosolv process: fractionation and process optimization, Ind. Eng. Chem. Res., 46(8), 2609-2617(2007).  17. C. S.. Goh, K. T.. Lee, N.. Brosse, Evaluation and optimization of organosolv pretreatment using combined severity factors and response surface methodology, Biomass and Bioenergy., 35(9), 4025-4033(2011).  18. M.. Brahim, N.. Boussetta, N.. Grimi, E.. Vorobiev, I.. Zieger-Devin, N.. Brosse, Pretreatment optimization from rapeseed straw and lignin characterization, Ind. Crops. Prod., 95, 643-650(2017).  19. Y.. Kim, A.. Yu, B.. Chung, M.. Han, G.. Choi, Lignin removal from barley straw by ethanosolv pretreatment, KSBB J., 24(6), 527-532(2009).
20. P.. Kumar, D. M.. Barrett, M. J.. Delwiche, P.. Stroeve, Methods for Pretreatment of Lignocellulosic Biomass for Efficient Hydrolysis and Biofuel Production, Ind. Eng. Chem. Res., 48(8), 3713-3729(2009).  21. A.. Sluiter, B.. Hames, R.. Ruiz, C.. Scarlata, J.. Sluiter, D.. Templeton, Determination of Total Solids in Biomass and Total Dissolved Solids in Liquid Process Samples: Laboratory Analytical Procedure (LAP) National Renewable Energy Laboratory(2008).
22. A.. Sluiter, B.. Hames, R.. Ruiz, C.. Scarlata, J.. Sluiter, D.. Templeton, Determination of Ash in Biomass: Laboratory Analytical Procedure (LAP) National Renewable Energy Laboratory(2012).
23. A.. Sluiter, B.. Hames, R.. Ruiz, C.. Scarlata, J.. Sluiter, D.. Templeton, D.. Crocker, Determination of Structural Carbohydrates and Lignin in Biomass.: Laboratory analytical procedure (LAP) National Renewable Energy Laboratory(2012).
24. TAPPI, Acid-insoluble lignin in wood and pulp Technical Association of the Pulp and Paper Industry(2012).
25. A.. Sluiter, R.. Ruiz, C.. Scarlata, J.. Sluiter, D.. Templeton, Determination of Extractives in Biomass: Laboratory Analytical Procedure (LAP) National Renewable Energy Laboratory(2008).
26. Y.. Zheng, Z.. Pan, R.. Zhang, J. M.. Labavitch, D.. Wang, S. A.. Teter, B. M.. Jenkins, Evaluation of different biomass materials as feedstock for fermentable sugar production, Appl. Biochem. Biotechnol., 136-140423-435(2007).
|
|













